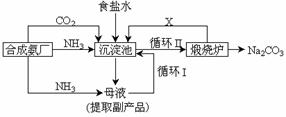
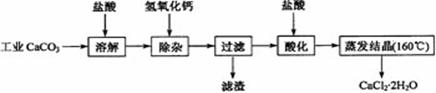
3.(江苏省赣榆一中2010届高三12月阶段考试化学)工业碳酸钠(纯度约为 98 % )中含有 Ca2+、 Mg2+、 Fe3+、 Cl-和 SO42-等杂质,提纯工艺线路如下:
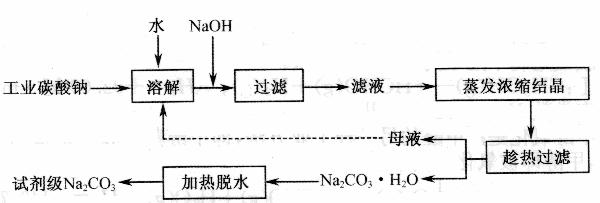
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:

Ⅱ.有关物质的溶度积如下
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
Fe(OH)3 |
|
Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1) 加入NaOH溶液时,反应的离子方程式为 。
向含有Mg 2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,
c(Mg 2+)∶c(Fe3+)==
( 2 ) “母液”中除了含有 Na+、 CO32-离子外 ,还含有 等离子。
( 3 )有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析实际工业生产中是否可行 (填“可行”或“不可行”)并说明理由 。
( 4 )已知: Na2CO3 ·10H2O ( s ) ==Na2CO3 ( s ) + 10H2O ( g ) △H==+532 .36 kJ·mol-1
Na2CO3 ·10H2O ( s ) ==Na2CO3·H2O ( s ) + 9H2 O( g ) : △H =+473 . 63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式
( l ) MgCO3 + 2OH-== Mg(OH )2+ CO32-( 2 分)(说明:书写 Fe3++ 3OH-= Fe ( OH )3↓、 Mg2++ 2OH-== Mg(OH )2↓不扣分,但也不得分) 2 .125×1021 , ( 2 分)
( 2 ) Cl-、 SO42-( 2 分,写出一个得 1 分,只要写错一个不得分)
( 3 )不可行( 2分)
若“母液”循环使用,则溶液: c(Cl-)和c(SO42-)增大,最后所得产物 Na2 CO3 混有杂质(2分)
( 4 ) Na2 CO3·H2O ( s )== Na2 CO3( s ) + H2O ( g ) ; △ H =+58 . 73kJ·mol-1 ( 2 分)
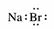 下列化学用语正确的是( )
下列化学用语正确的是( )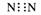 A.氮分子的电子式: B.溴化钠的电子式:
A.氮分子的电子式: B.溴化钠的电子式: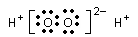
 A、①②④
B、①②⑤
C、只有⑤
D、②④⑤
A、①②④
B、①②⑤
C、只有⑤
D、②④⑤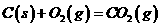 ;
;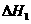 C(s)+1/2
C(s)+1/2  =CO(g);
=CO(g);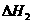 ,则
,则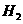 (g)+
(g)+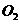 (g)=
(g)=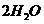 (g);△H =-483.6kJ/mol,则氧气的燃烧热为24l.8kJ/mol
(g);△H =-483.6kJ/mol,则氧气的燃烧热为24l.8kJ/mol (
(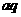 )+
)+ (
(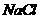 (
(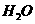 (
(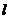 )△H =-57.3kJ/mol,则含20g
)△H =-57.3kJ/mol,则含20g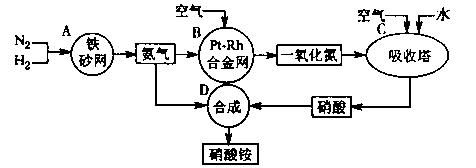
 2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有
。(填字母)
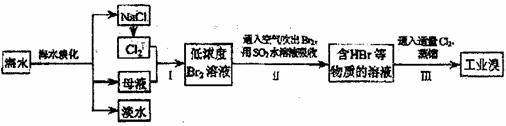
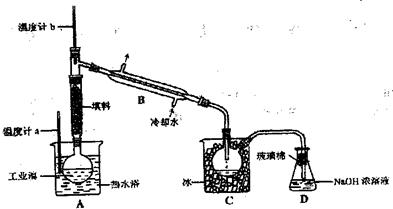 (5)某化学研究性学习小组为了了解从工业溴水中提纯溴的方法,查阅有关资料知Br2的沸点为59°C。微溶于水,有毒性和强腐蚀性。他们参观了有关生产过程后,设计了如下装置简图在实验室模拟工业提纯过程:
(5)某化学研究性学习小组为了了解从工业溴水中提纯溴的方法,查阅有关资料知Br2的沸点为59°C。微溶于水,有毒性和强腐蚀性。他们参观了有关生产过程后,设计了如下装置简图在实验室模拟工业提纯过程: