9.(江苏省高淳中学2010届高三上学期调研(化学))在2 L密闭容器内,800 ℃时反应:2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
⑴写出该反应的平衡常数表达式:K= 。
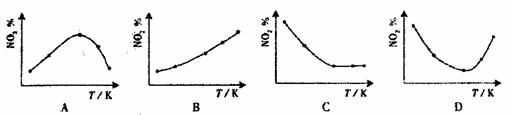
 ⑵右图中表示NO2的变化的曲线是
。
⑵右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应的平均速率v= 。
⑶能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变
⑷某同学查阅资料得知,该反应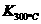 >
>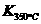 ;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
;25 ℃时,生成1 mol NO2,热量变化为56.4 kJ。但是该同学由于疏忽,忘记注明“+”、“-”。根据题目信息,该反应的热化学方程式为
。
⑸ 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(1)K=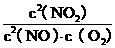 ………………………………………2分
………………………………………2分
(2)b …………………………………………………………………2分
8.(江苏省高淳中学2010届高三上学期调研(化学))硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O。下列各组实验中最先出现浑浊的是
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
7.(江苏省赣榆一中2010届高三12月阶段考试化学)(1)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4  2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
|
时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
|
n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
|
n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s-40s内用N2O4表示的平均反应速率为 mol/(L.s)
②计算在80℃时该反应的平衡常数K= ;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”) ;
④要增大该反应的K值,可采取的措施有(填序号)
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(1)①0.0020 (1分);②1.8 (1分); ③变浅 (1分); ④ D (1分)
(2)①14HNO3+3Cu2O==6Cu(NO3)2+2NO↑+7H2O (1分)
②0.6mol(1分)
③使用了较浓的硝酸,产物中有部分二氧化氮生成(1分)
5.(江苏省丹阳高级中学2010届高三上学期期中考试(化学))利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O=CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)500℃、50MPa时,在容积为V L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K= 。
(1)CH4(g)+H2O(g)=CO(g)+3H2(g); △H =+206.1 kJ·mol-1(2分)
(2)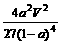 (2分)
(2分)
 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol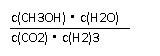 ⑴.①.0.225 ②.
③.C、D
⑴.①.0.225 ②.
③.C、D 

 P
P



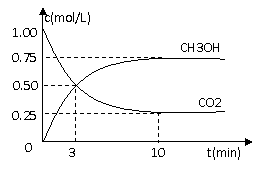
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
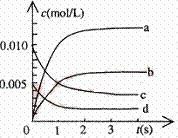
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol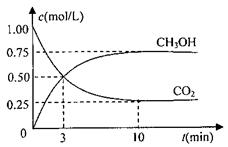 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。 N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-93.4kJ/mol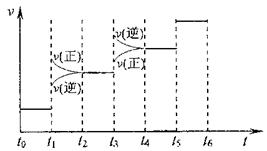 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。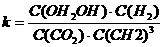 减小
减小