0 41195 41203 41209 41213 41219 41221 41225 41231 41233 41239 41245 41249 41251 41255 41261 41263 41269 41273 41275 41279 41281 41285 41287 41289 41290 41291 41293 41294 41295 41297 41299 41303 41305 41309 41311 41315 41321 41323 41329 41333 41335 41339 41345 41351 41353 41359 41363 41365 41371 41375 41381 41389 447348
 (8分) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l
、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题:
(8分) 铜合金是人类使用最早的金属材料,铜在化合物中的常见化合价有+l
、+2。已知Cu2O与稀硫酸反应,溶液呈蓝色。现向Cu、Cu2O和CuO组成的混合物中,加入1 L 0.6 mol/L HNO3溶液恰好使混合物溶解,同时收集到2240 mL NO气体(标准状况)。请回答下列问题: .某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积
.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积
 ⑴取适量试液,加入过量盐酸,有气体生成,并得到溶液; Blog/?UserId=997609
⑴取适量试液,加入过量盐酸,有气体生成,并得到溶液; Blog/?UserId=997609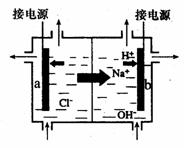
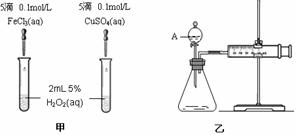
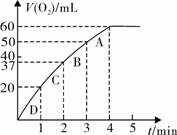 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。 气体所需时间为 min。
气体所需时间为 min。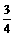 气体所需时间约为
min。
气体所需时间约为
min。
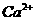 、H+、
、H+、 、
、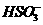
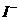 、
、
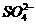 、
、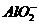
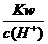 =0.1 mol/L的溶液:Na+、K+、
=0.1 mol/L的溶液:Na+、K+、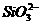 、
、