24. (8分)(1)在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
 CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO(g)+H2O(g) CO2(g)+H2(g) △H<0
 Co和H2O浓度(mol/L)变化如下图,则0-4min的平均反应速率
Co和H2O浓度(mol/L)变化如下图,则0-4min的平均反应速率
v(H2O)= mol·(L·min)-1
|
时间/min |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
(2)t℃时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min-4min之间反应处于 状态;若c1数值大于0.08 mol·L-1,则温度t 850℃(填“>”、“<”或“=”)。
②表中5min-6min之间数值发生变化,可能的原因是 。
A.升高温度 B.体积不变,通入水蒸气
C.缩小体积,增大压强 D.体积不变以,通入氢气
21.(12分)某实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡,溶液呈黄色。
(1)提出问题 Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是
含 (填化学式,下同)所致;
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是
含 所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液; b.CCl4; c.无水酒精; d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象(试剂填序号)。
|
|
选用试剂 |
实验现象 |
|
方案1 |
|
|
|
方案2 |
|
|
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
(5)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是 (填离子符号);
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),若溶液中有的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
17.下述实验能达到预期目的的是
|
编号 |
实验内容 |
实验目的 |
|
A |
将10g CuSO4·5H2O溶解在90g水中 |
配制质量分数为10%的CuSO4溶液 |
|
B |
将Cl2通入NaBr溶液中 |
比较氯与溴的氧化性强弱 |
|
C |
向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
制备Fe(OH)3胶体 |
|
D |
]向某溶液中滴加BaCl2溶液有白色沉淀生成 |
证明该溶液中一定含有SO42-离子 |
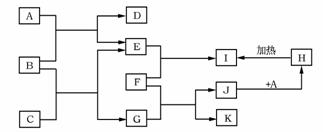 (13分)字母A~K各表示一种物质,其转化关系如图所示,有的反应在溶液中进行,有的反应部分产物已略去。其中E、F、K为单质,其它均为化合物;A、E、K为无色气体,B为淡黄色固体,C为无色液体;F为常见的金属,高温下与某些金属氧化物反应,是工业上冶炼金属的方法之一。
(13分)字母A~K各表示一种物质,其转化关系如图所示,有的反应在溶液中进行,有的反应部分产物已略去。其中E、F、K为单质,其它均为化合物;A、E、K为无色气体,B为淡黄色固体,C为无色液体;F为常见的金属,高温下与某些金属氧化物反应,是工业上冶炼金属的方法之一。
 转化关系,
,满足条件的甲和乙为
转化关系,
,满足条件的甲和乙为