26.(10分)硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过下列实验由废铁屑制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热浸泡一会,除去Na2CO3溶液,然后将废铁屑用水洗涤2-3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度50-80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置.冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2-3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广囗瓶中,密封保存。
请回答下列问题:
(1)实验步骤①的目的是__________________ ,
加热的作用是___________________ _。
(2)实验步骤②明显不合理,理由是_______________________
。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是_____________ 、
_______________ 。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O.FeSO4·4H2O
和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成,如下表
所示(仅在56.7℃.64℃温度下可同时析出两种晶体)。
|
温度/℃ |
0 |
10 |
30 |
50 |
56.7 |
60 |
64 |
70 |
80 |
90 |
||
|
溶解度/g |
14.0 |
17.0 |
25.0 |
33.0 |
35.2 |
35.3 |
35.6 |
33.0 |
30.5 |
27.0 |
||
|
析出晶体 |
FeSO4·7H2O |
FeSO4·4H2O |
FeSO4·H2O |
|||||||||
请根据表中数据,若从硫酸亚铁溶液中结晶出FeSO4·4H2O晶体,应控制的结晶温度
(t)的范围为_________ 。
25.(6分)实验室用铜和硫酸制取CuSO4有几种方法:
甲学生进行了下列实验:取6.4g铜片和10mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶
中还有较多的硫酸剩余。他这样认为的理由是:
。
|
CuO+H2SO4 == CuSO4+H2O。对比甲的方案,乙同学的优点是:
;
为了同样达到乙同学的优点,你能不能根据电化学原理也设计一个用铜和稀硫酸制
取CuSO4的方案?(其它材料任选):
 H2↑+C12↑
H2↑+C12↑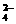 2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-