17.(11分)碘酸钾是一种白色结晶粉末,无臭无味,酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氯酸盐等氧化为高碘酸钾。碘酸钾在常温下稳定,加热至560℃开始分解。工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平)
(1)碘的原子序数为________。
(2)在反应器中发生的反应I2+KClO3+H2O→KH(IO3)2+KCl+Cl2(未配平),生成两种还原产物所得电子数目相同,请写出已配平的该反应的化学方程式:________________________________________________________。若有1 mol I2完全反应,则该反应中转移电子的数目为________(设NA表示阿伏加德罗常数)
(3)步骤②中,用硝酸而不用HI,其原因可能是________________________。
(4)步骤③要保持溶液微沸1小时以完全排出氯气,排出氯气的原因为________________________________。
(5)参照下表碘酸钾的溶解度,步骤11得到碘酸钾晶体,你建议的方法是________________________________。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
KIO3g/100g水 |
4.60 |
6.27 |
8.08 |
12.6 |
18.3 |
24.8 |
(6)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+H2O=KIO3+H2↑,则两极的电极反应式分别为:
阴极________________________________________,阳极________________________________________。
(7)根据你的生活经验和化学知识,谈谈怎样正确使用加碘盐?________________________________________。
(只要说出一种即可)
(1)53;(2)6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2、10NA;(3)HI具有还原性,能将已生成的碘酸氢钾还原;(4)Cl2能将KIO3氧化成KIO4;(5))蒸发结晶;(6)6H2O+6e-=2H2↑+6OH-、I-+6OH--6e-=IO3-+2H2O;(7)做好饭菜再放食盐
15.醋酸是重要的一元酸,在有机和无机反应中都有应用。
(1)在酯化反应的实验中,乙酸、乙醇的用量和平衡时乙酸乙酯的生成量如下表
|
反应 |
乙醇/kmol |
乙酸/kmol |
乙酸乙酯/kmol |
|
1 |
2 |
2 |
1.33 |
|
2 |
3 |
2 |
1.57 |
|
3 |
4 |
2 |
X |
|
4 |
5 |
2 |
1.76 |
①该酯化反应的平衡常数K的表达式为:K=______________________________
②由表中数据推测,数值X的范围是____________推断的依据为________________________
③假设乙醇的价格为500元/k mol,乙酸乙酯的价格为1600 元/kmol,同反应2相比,反应3的经济效益________(填:增加或减少)
(2)10 mL 0.10 mol·L-1的稀醋酸中存在着平衡:CH3COOH CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线
CH3COO-+H+。①向稀醋酸中不断加水②向稀醋酸中慢慢滴加0.10 mol·L-1的稀氢氧化钠溶液。①中醋酸电离度的变化图线已画出,请你在下图中画出②过程中醋酸电离度的变化图线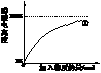
(1)K=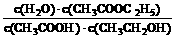 (2分);(2)1.57<X<1.76(1分),在乙酸的物质的量相同条件下,增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯的物质的量减少(2分);(3)减少(1分)
(2分);(2)1.57<X<1.76(1分),在乙酸的物质的量相同条件下,增加乙醇的物质的量平衡向右移动,乙酸乙酯的物质的量增加,减少乙醇的物质的量平衡向左移动,乙酸乙酯的物质的量减少(2分);(3)减少(1分)
(4)(2分)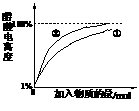
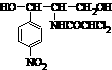 13.2007年 1月20日有关媒体报道“迪豆痘速消含氯霉素”事件。连日来,全国各省市卫生、质检、工商等部门已经对市面上销售的迪豆痘速消立即进行了多批次反复抽检。各地卫生主管部门最新通报,所有检测报告结果均表明迪豆痘速消不含氯霉素,安全合格,广大消费者可放心选购使用。氯霉素是世界上第一个用化学方法全合成的抗生素,它的化学结构式如图。下列有关说法不正确的是BC
13.2007年 1月20日有关媒体报道“迪豆痘速消含氯霉素”事件。连日来,全国各省市卫生、质检、工商等部门已经对市面上销售的迪豆痘速消立即进行了多批次反复抽检。各地卫生主管部门最新通报,所有检测报告结果均表明迪豆痘速消不含氯霉素,安全合格,广大消费者可放心选购使用。氯霉素是世界上第一个用化学方法全合成的抗生素,它的化学结构式如图。下列有关说法不正确的是BC 的溶液中一定存在如下离子:Na+、Al3+、NO3-、Cl-
的溶液中一定存在如下离子:Na+、Al3+、NO3-、Cl-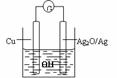 普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是AC
普通水泥在固化过程中自由水分子减少并产生,溶液呈碱性。根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间。此法的原理如图所示,反应的总方程式为:2Cu+Ag2O=Cu2O+2Ag,下列有关说法正确的是AC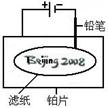 某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“
某学生设计了如图所示的“黑笔写红字”的趣味实验。滤纸上先用NaCl和无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹--“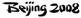 ”。据此,下列叙述不正确的是C
”。据此,下列叙述不正确的是C