26(A)、(12分)某校学生为探究苯与溴发生反应的原理,改进了课本中该反应的装置(如下图所示,左图为原来课本装置,右图为改进后的装置)。

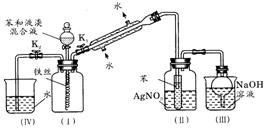
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅱ)中小试管内可能观察到的现象是__________________________;小试管外可能观察到的现象是__________________________________________;小试管中苯的作用是_________________________________。
(2)改进后的装置中能防止倒吸的装置有_________________。(填装置序号)
(3)反应结束后,如何使(Ⅳ)中的水倒吸入(Ⅰ)中?请简述操作过程:
_____________________________________________________________________。
(4)与改进前的装置相比较,改进后的装置能否证明苯和溴发生了取代反应?________(填“能”或“不能”),其理由是:__________________________________________。
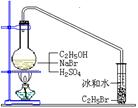 26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
26(B)、(12分)在实验室中制备溴乙烷(C2H5Br)通常采用以下方法:在烧瓶中加NaBr(约2–3g),适量水,加少量乙醇,再加两倍于乙醇的浓硫酸(1:1),塞上带有长导管的塞子,长导管的另一端插入装有冰水混合物的试管中,用酒精灯隔石棉网对反应物加热。已知溴乙烷的沸点为38.4℃,其密度比水大,常温下为不溶于水的油状液体。请回答下列问题:
(1)现有98%的浓硫酸、蒸馏水、100mL烧杯、20mL量筒、玻璃棒等,写出配制20mL 1:1浓硫酸的操作过程:_________________________________________________________________________
_________________________________________________________________________。
(2)此反应中使用1:1的浓硫酸,与使用98%的浓硫酸相比其优点有(写二条):
①______________________________;②_________________________________。
(3)写出该方法制备C2H5Br的化学方程式:
__________________________________________________________________________。
(4)使用98%浓硫酸,发生副反应的化学方程式为________________________________。
(5)溴乙烷用冰水混合物收集的依据是_______________________________________
__________________________________________________________________________。
27、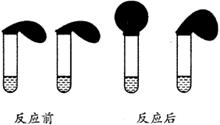 (12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(12分)某教材中有这样一个实验:在两支试管中分别加入3mL某浓度的稀盐酸(足量),将两个各装有0.3g NaHCO3和 Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒入试管中,观察到现象如右图:
(1)盛______________(填化学式)的试管中气球变得更大, 大小气球(不计气球的弹力和气体温度影响) 体积之比约为(填最简单整数比)____________。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3粉末的试管变热。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了如下热化学方程式(其中“aq”代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq) →H2O(l)+ CO2(g) +Q1; Q1<0
CO32-(aq)+ 2H+(aq) → H2O(l) + CO2(g) +Q2; Q2 >0
甲同学所作结论的方法是否正确?___________(填“正确”或“不正确”)。
(3)为研究该反应是吸热还是放热反应,某研究小组以《NaHCO3、Na2CO3 和盐酸反应过程中热效应的研究》为研究课题,进行了如下实验(每次实验各做三次,取平均值):
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高 或最低温度 |
|
① |
35mL水 |
2.5g NaHCO3固体 |
20℃ |
18.5℃ |
|
② |
35mL水 |
3.2 Na2CO3固体 |
20℃ |
24.3℃ |
|
③ |
35mL稀盐酸 |
含2.5g NaHCO3的饱和溶液32.5mL |
20℃ |
19℃ |
|
④ |
35mL稀盐酸 |
含3.2g Na2CO3的饱和溶液23.1mL+10ml水 |
20℃ |
24.2℃ |
|
⑤ |
35mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
16.2℃ |
|
⑥ |
35mL稀盐酸 |
3.2g Na2CO3固体 |
20℃ |
25.1℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为______________和_______________;
(4)通过上述实验可以得出_____________(填字母编号)。
A、NaHCO3的溶解是吸热过程 B、NaHCO3的饱和溶液和盐酸的反应是吸热反应
C、Na2CO3的溶解是放热过程 D、Na2CO3的饱和溶液和盐酸的反应是吸热反应
(5)结论:影响NaHCO3固体与稀盐酸反应的反应热因素有________________________
____________________________________________________。
|
族
周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
一 |
① |
|
|||||
|
二 |
② |
③ |
④ |
⑤ |
|
⑥ |
|
|
三 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑨的氢化物的化学式为 ,此氢化物的还原性比元素⑥的氢化物的还原性 (填“强”或“弱”)。
(2)表中某元素原子的最外层p电子数比s电子数少1,则该元素的元素符号是 。
(3)表中给出元素单质可以形成原子晶体的是 (填序号)。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与NaOH溶液反应的离子方程式:
。
23(B)、(8分)下表是元素周期表的一部分,表中所列字母分别代表一种化学元素:
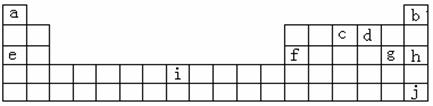
(1)b、h、j的单质熔点由高到低的顺序_____________(填字母)。
(2)以上元素形成的金属单质中,熔点最低的是_________(填元素符号)。
(3)f元素单质是在生活、生产中用量很大的金属之一,试写出工业上制备f元素单质的化学方程式_________________________________________________。
(4)c元素的单质用途_____________________________________________、________________________________________(填二条)。
24、(8分)含氮废水进入水体对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:
____NO3-+ ____Al+ ____H2O → ____N2↑+ ____Al(OH)3↓+ ____OH-
(2)上述反应中,还原剂是_________,被还原的元素是_________,每生成2mol N2,将有_________ mol电子发生转移。
(3)有上述废水100m3,若要完全消除污染,则所消耗金属铝的质量为_________g。
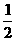 的比值
的比值 (2)取(1)反应后所得溶液10.0mL用0.100mol/L 盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?
(2)取(1)反应后所得溶液10.0mL用0.100mol/L 盐酸滴定至酚酞终点。需该浓度的盐酸多少毫升?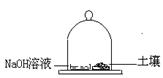 (3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL
0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。
(3)称取25.0g土壤试样置于玻璃钟罩的密闭空间内,同时也放入盛有100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液,用15.7mL
0.100mol/L盐酸滴定至酚酞终点。同样的实验不放土壤(空白实验)放入盛有同浓度100mLNaOH溶液的圆盘以吸收CO2,48h后取25.0mLNaOH溶液需上述盐酸25.4mL,计算在细菌作用下土壤释放 CO2的速度,以mg CO2/[g(土壤)•h]表示。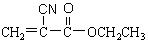 )。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式:
)。在空气中微量水的催化下发生加聚反应,迅速固化而将物品粘牢。请写出“502胶”发生粘合作用的化学方程式: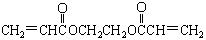 )也是一种粘合剂,在空气中较稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为
)也是一种粘合剂,在空气中较稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种粘合剂。这一制取过程的化学方程式为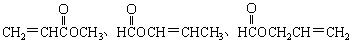 。已知含有
。已知含有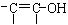 结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的
结构的物质不能稳定存在。请另外任写两种含-CH=CH-结构的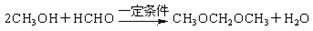 可以发生。聚乙烯醇
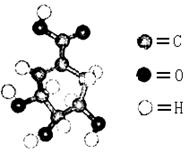
可以发生。聚乙烯醇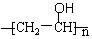 可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:
可用做普通胶水,它的羟基可全部与丁醛缩合脱水,得到含六原子环的强力粘合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式: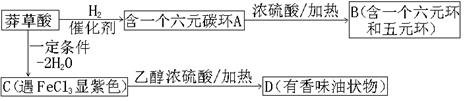
 2NH3(g)达到平衡:
2NH3(g)达到平衡:
 高三年级质量监控
高三年级质量监控 第Ⅱ卷(共84分)
第Ⅱ卷(共84分)