23.(12分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
|
物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
|
熔点/℃ |
660 |
2054 |
1535 |
1462 |
|
沸点/℃ |
2467 |
2980 |
2750 |
-- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为______________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ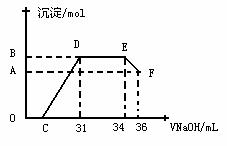 .
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
.
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________ _______。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ ___;
上述现象说明溶液中 、 、_______结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。

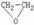 。
。 F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a
mol·L-1 ,F、G浓度仍为0。当达到新的平衡时,①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>” “<” “=”)。
F(g)+x G(g);ΔH<0。若起始时E浓度为a mol·L-1 ,F、G浓度均为0,达平衡时E浓度为0.5a mol·L-1 ;若E的起始浓度改为2a
mol·L-1 ,F、G浓度仍为0。当达到新的平衡时,①若x=l,容器体积保持不变,新平衡下E的体积分数为 ; ② 若x=2,容器体积保持不变,新平衡下F的平衡浓度 0.5a mol·L-1 (填 “>” “<” “=”)。 X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白:
X C(g),2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4 mol·L-1;请填写下面空白:
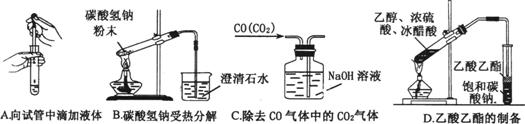
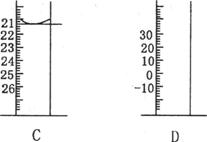
 A B
C D
A B
C D
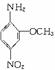
 )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是