21(10分)、现有废液,其中含有CuCl2、FeCl2、HCl。某课外活动小组计划用它得到纯净的FeCl2晶体。为此设计如下实验方案:
|
序号 |
A |
B |
C |
D |
E |
|
仪器及药品 |
 |
 |
 |
 |
 |
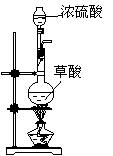
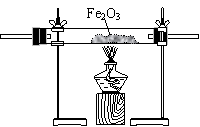
第一步:用上图中的仪器和药品组装一套实验装置制取干燥的CO,用CO还原Fe2O3粉末制取还原铁粉。
(制取CO的原理为:H2C2O4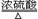 CO2↑+CO↑+H2O)
CO2↑+CO↑+H2O)
(1)如果所制气体流向从左向右时,上述组装的实验装置从左向右的实验装置连接顺序(填仪器序号)是 → → → → 。
(2)正确的操作第一步应是 ;最后一步应是
熄灭 处的酒精灯。
(3)装置B的作用是 ;装置E的作用
是 。
第二步 :将制得的还原铁粉放入原混合溶液中,制得纯净的FeCl2溶液。
(4)必须进行的操作是 。
第三步:得到纯净的FeCl2晶体。
(5)必须进行的操作是 。
22(10分)、工业上用饱和食盐水作原料,用电解方法制取烧碱。 (1)写出电极反应和总化学方程式:阳极______________________,阴极_________________________;总反应________________________。 (2)NaOH在_________极附近生成; (3)电极材料为石墨和铁网,阳极必须用_________,原因是
___________________________________________; (4)电解过程中可能发生的副反应有两个,它们是: ______________________________________,
(5)若将电解槽内的隔膜去掉,同时升高电解液的温度,此时电解产物间发生反应:NaOH+Cl2→NaClO3+NaC1+H2O(未配平),假设反应进行完全,则在该条件下最后得到的两种产物的物质的量之比是______________
(6)若在NaClO3溶液中加入固体KCl,则可得到重要工业产品KClO3晶体,其原因是_______________________________________________。
23(10分)、如下图所示,A溶液呈蓝色。(图中参加反应的水及生成的水已略去) 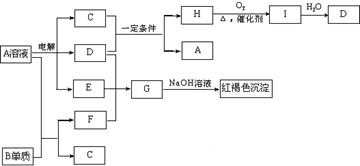 请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
请回答下列问题:
(1)写出电解A溶液的离子方程式:
;
(2)写出C和D在一定条件下反应的化学方程式:
;
(3)写出G的化学式:
;
(4)若欲将A溶液与B单质反应的化学能转化为电能,则所设计的原电池的正极材料可以是: ;负极的反应式是:
。
24(10分)、取0.04molKMnO4固体,加热一段时间后将剩余固体与浓盐酸共热,收集到气体 V(L)(标准状况)。若KMnO4的分解率为x ,HCl挥发忽略不计,与盐酸反应后Mn元素全部以Mn2+存在,则:
(1)V= L(用含x的代数式表示)。
(2)当x= 时,V的值最水,其值为 L。
(3)当V=2.016L时,第一次加热所得固体的质量为 g。
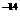 mo1·L
mo1·L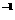 ,则该溶液中,一定能大量共存的离子组是
,则该溶液中,一定能大量共存的离子组是
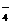 、SO
、SO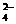 B.K+、Cl
B.K+、Cl 、Ba2+、HCO
、Ba2+、HCO
 、C1
、C1
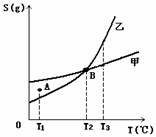 甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是
甲、乙两种物质溶解度曲线如右图所示:下列说法一定正确的是