18、(12分)某研究性学习小组在探究铜锌与浓盐酸反应,设计了如下实验方案一、
实验用品:纯锌片,37%的浓盐酸,铜片,蒸馏水,氯化铜溶液。
甲:将锌放入浓盐酸中,反应速率较快
乙:将实验过程记录下来,并交流。
|
|
根据上述资料与交流材料回答下列列问题
⑴乙反应速率明显比甲快,原因是: 。
⑵丙、丁根据铜位于金属活动顺序表氢之后,与盐酸不反应,对乙产生的气体体积比
甲大的事实。
作出如下推断:
①丙认为是溶解在溶液中的H2逸出,你认为是否有道理,理由是: 。
②丁作了如下猜想,是否成立,请你设计实验方案。
|
丁猜想 |
验证方法 |
预测现象及结论 |
|
丁认为铜片中 可能含有锌等杂质 |
|
|
⑶戊注意到乙中(3)中的白色沉淀,分析:不可能是CuCl2,因为CuCl2溶液显蓝色或绿色,也不可能是氯化锌,因为稀释后溶液更稀,不会析出。并利用资料①②大胆猜想,白色沉淀是生成的氯化亚铜。请你帮他设计验证方案(若有多个只设计两个方案):
|
戊 |
预计验证方法 |
预测的现象与结论 |
|
白色沉淀 是氯化亚铜 |
|
|
|
|
|
⑷指导老师肯定了戊的猜想,请结合资料③,写出铜与足量浓盐酸在加热条件下反应生成无色溶液及气体,化学方程式可能是: 。
乙的实验步骤(3)稀释,生成沉淀,实际上是一个平衡问题,请写出这一平衡关系:
(用离子方程式表示)。
 5Fe3+ + Mn2+ + 4H2O),原样品中Fe3O4、Fe2O3的质量分数分别多少。
5Fe3+ + Mn2+ + 4H2O),原样品中Fe3O4、Fe2O3的质量分数分别多少。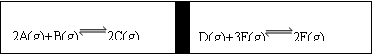
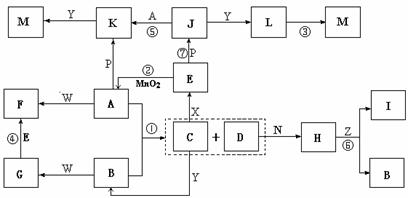
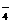 被还原为Mn2+,SO2被氧化成SO
被还原为Mn2+,SO2被氧化成SO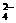 。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置: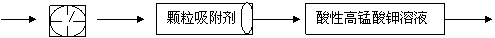


 ①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过
①其中: 或 表示密闭容器;
表示气体流速管(单位时间内通过 气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入
气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入 的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。
的颗粒; 表示气体的流向。②酸性KMnO4溶液体积为200mL,浓度为0.1mol·L-1。 Cu2O(红色)+CH3COOH +2H2O
Cu2O(红色)+CH3COOH +2H2O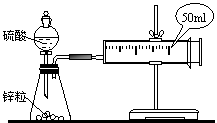 ⑤熔融氢氧化钠要在耐高温的石英坩埚中
⑤熔融氢氧化钠要在耐高温的石英坩埚中