28.(15分)
Ⅰ(7分)(1)25 ℃时,取0.2 mol·L-1盐酸与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合液中水电离出的c(H+)_________原盐酸中水电离出的c(H+);(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字)
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH)=__________ mol·L-1
(2)25 ℃时,如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则溶液中各离子浓度由大到小的顺序为
Ⅱ.(8分)下表是三个不同短周期部分元素的原子半径及主要化合价:
|
元素代号 |
W |
R |
X |
Y |
Z |
|
原子半径/nm |
0.037 |
0.157 |
0.066 |
0.70 |
0.077 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2、+4 |
试回答下列问题:
⑴五种元素中原子半径最大的元素在周期表中位于 。
⑵写出下列有关反应的化学方程式:
①Z的单质与Y元素的最高价氧化物对应的水化物反应: ;
②R2X2与ZX2反应: 。
⑶X可与Z形成一种有恶臭味的气体,该气体与氧气发生反应的物质的量之比为1:2,且反应前后气体的总体积不变,试写出该气体分子(分子中各原子最外层均满足8e-结构,且含有非极性键)的电子式 。
 (4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
(4)已知Z的燃烧热是393.5kJ/mol,表示Z的燃烧热的热化学方程式是 ;
13.下列叙述中,正确的是
①中和10 mL 0.1 mol·L-1醋酸与中和100 mL 0.01 mol·L-1醋酸所需同种碱液的量不同
②体积相同、pH相等的盐酸和硫酸溶液中,H+的物质的量相等
③常温下,pH=3的甲酸溶液中c(H+)与pH=11的氨水中的c(OH-)相等
④锌与pH= 4的盐酸反应比跟pH=3的醋酸溶液反应程度剧烈
A.①③ B.①④ C.② D.②③






|
|
|
老师寄语:态度决定一切,细节决定成败。
 高2007届理科 班 姓名__________
得分____________
高2007届理科 班 姓名__________
得分____________
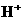 反应,调节溶液的pH在4-5之间使
反应,调节溶液的pH在4-5之间使 完全水解(1分);
完全水解(1分); (1分)
(1分) (2分) (3)A、B、D、E;(2分)
(2分) (3)A、B、D、E;(2分) (2分) (6)电,化学 (2分)
(2分) (6)电,化学 (2分)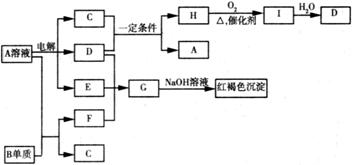
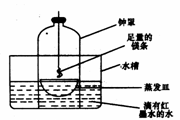
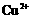 几乎不水解,而
几乎不水解,而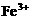 几乎完全水解。某学生拟用电解
几乎完全水解。某学生拟用电解 溶液的方法测定铜的相对原子质量.其实验流程图如下:
溶液的方法测定铜的相对原子质量.其实验流程图如下:


 ,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。 ③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的
,则固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物。 ③固体氢氧化钠部分吸收了空气中的二氧化碳并溶于水后,溶液中含有较多的
 A.澄清石灰水中滴加少量Ca
(HCO3)2溶液:Ca2+ + OH + HCO3- H2O +
CaCO3↓
A.澄清石灰水中滴加少量Ca
(HCO3)2溶液:Ca2+ + OH + HCO3- H2O +
CaCO3↓ 沉淀完全:
沉淀完全: +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O D.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
D.向含0.5molFeBr2的溶液中通入0.5molCl2:2Fe2+ + Cl2 2Fe3+
+ 2Cl- Z(g)+W(s);ΔH>0 则下列叙述正确的是
Z(g)+W(s);ΔH>0 则下列叙述正确的是