2、氯酸钾是一种强氧化剂,多用来制造火柴和烟花等。制取氯酸钾的方法有两种:第一种,无隔膜电解热的氯化钾水溶液,电解的生成物相互反应制得氯酸钾。
①电解池中电极反应的方程式是
阴极: ,阳极: 。
②写出生成氯酸钾的离子方程式,并标明电子转移的方向和数目 。
第二种,无隔膜电解热的氯化钠水溶液,然后用电解后溶液中的一种产物与等物质的量的氯化钾水溶液混合制得氯酸钾。
③第二种方法中制得氯酸钾的化学方程式是 ,该反应能够进行的原因是 。
④已知下列各物质的价格如下表:
|
物质 |
NaCl |
KCl |
NaClO3 |
KClO3 |
KOH |
|
价格(元/50kg) |
500 |
1900 |
4200 |
26000 |
10600 |
从经济效益分析,上述方法中的第 种方法更好,理由是
。
10.64g/cm3,1体积的钯粉大约可吸附标准状况下896体积的氢气,则钯的氢化物的化
学式为
(3)因氢气易燃易爆,贮运安全极为重要。已知氢气的燃烧热为285.8kJ·mol-1.
写出其完全燃烧的热化学方程式:
(4)某学生查阅大量资料,提出下列“22世纪用水制取氢气的研究方向”:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量
②设法将太阳光聚焦,产生高温,使水分解产生氢气
③寻找高效催化剂,大力提高水在一定条件下分解产生氢气的转化率
④寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
请你从上述研究方向中,选择其中不正确的一项,并简述其理由
题型三: 化学与食品
去年9月底,国家质检总局查处了在食品中使用“雕白块”七大案例。“雕白块”的化
学名称为甲醛次硫酸氢钠,违法者往食品中添加“雕白块”是为了漂白增色、防腐、增加米面制品的韧性及口感。但人食用“雕白块”后会刺激肠道,引起过敏和食物中毒,容易致癌。已知“雕白块”是甲醛和次硫酸氢钠(可表示成Na+[OSOH]-)反应制得:
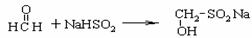
回答下列问题:
(1)“雕白块”_______________(填“易”或“微”或“难”)溶于水。“雕白块”具有________(填“强还原性”或“强氧化性”),写出“雕白块”溶液中滴加足量碘水所发生反应的化学方程式_____________________________________。
(2)写出次硫酸氢根的电子式___________________________。
(3)写出水溶液中次硫酸氢钠和氢氧化钾反应的离子方程式____________________。
(4)甲醛能使__________变性凝固,所以可用其浓溶液保存动物标本。
(5)甲醛是非常重要的合成原料。纯净的甲醛在[F3B←O(CH2CH3)2]配位化合物的催化下,生成聚甲醛(是一种优良的工程塑料),聚甲醛的结构简式为_____________;俄国化学家 布特列洛夫在1861年首次发现在弱碱作用下,6个甲醛分子加合得到己糖,此己糖的分子式为___________。
题型四:化学与生产
江苏是一个沿海省份,海洋中含有大量的宝贵资源,卤族元素的单质和化合物主要是从海洋中获得的。溴单质是有机合成中一种重要的原料,最近还发现溴化镁具有高温超导性,它是一种较为廉价的高温超导材料。
工业上从海洋中制溴,先把盐卤(海水中氯化钠被分离后剩下的母液)加热到363K后控制PH为3.5,通入氯气把溴置换出来,再用一种气体X把溴吹出以碳酸钠吸收,这时溴就歧化生成溴离子和溴酸根离子,最后用硫酸酸化,单质溴就从溶液析出,用此办法从1t海水中可制得约0.14kg溴。
根据上述信息研究下列问题:
⑴把溴吹出的气体X,工业上最适宜选用( )
A、C2H4 B、空气 C、氩气 D、CO2
⑵某同学对上述工艺提出改进意见,认为在把溴吹出之前可以利用CCl4等有机溶剂直接把溴萃取出来,你认为该同学的建议是否合理? (填“是或否”),请说出你的理由
⑶提取溴的工厂往往会因为溴的挥发而造成周围空气的污染,某实验小组拟对空气中溴的含量进行测定,请你一起参与研究。
①采集空气样本需要选择不同地点,你建议选择的测定地点分别是
②收集气体样本是测定空气中溴的含量的关键之一,利用下列药品和仪器,请你为实验小组设计收集一瓶气体样本的方法。
药品:饱和氯化钠溶液 蒸馏水 饱和溴化钠溶液 1mol/L亚硫酸钠溶液
仪器:集气瓶 盖玻片
收集方法:
⑷用Na2CO3溶液吸收溴,再用硫酸酸化析出溴,是工业上获取溴的方法之一,用离子方程式表示该反应过程:① ;② ;工业上还可以通过电解盐卤的方法来获取溴,用惰性电极电解MgBr2溶液时,除得到溴外,获得的其他工业产品是 。
⑸卤仿反应是有机化学反应中的重要反应之一,可以用于测定化合物中是否具有CH3CO-或CH3CHOH-结构,反应如下(其中X为氯、溴或碘):
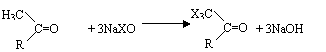 Ⅰ、
Ⅰ、
 Ⅱ、X3C-COR+NaOH X3CH+RCOONa
Ⅱ、X3C-COR+NaOH X3CH+RCOONa
你认为能够用于测定化合物中具有CH3CHOH-结构的可能原因是:
题型五:化学与生活
金属镁和铝在工农业生产以及人们日常生活中有着十分广泛的用途。某化学兴趣小组的
同学决定对镁、铝及其化合物的性质比较展开探究活动。搜索到的一些实验数据如下:
|
|
Mg |
Al |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
|
熔点℃ |
648.8 |
660 |
2852 |
2072 |
714 |
190(2.5个大气压) |
|
沸点℃ |
1107 |
2467 |
3600 |
2980 |
1412 |
182 |
|
|
电离能(使气态原子失去第一个电子所需的能量) |
燃烧热 (kJ/mol) |
|
溶解度 (g) |
|
Mg |
I1=7.65ev I2=15.0
ev |
835 |
Mg(OH)2 |
5×10-4 |
|
Al |
I1=5.99ev
I2=18.8ev I3=28.5ev |
602 |
Al(OH)3 |
1.6×10-8 |
探究过程中发现了一些“异常”。
⑴镁条在空气中点燃,发出耀眼的白光,用铝箔在酒精灯上加热,铝箔不能燃烧,铝箔卷缩悬垂却不脱落。将已“卷缩”铝箔冷却后投入氢氧化钠溶液中,有气体生成。
请说出铝箔“卷缩不脱落”的原因是 ;
⑵铝片插入硫酸汞溶液中,铝片表面灰暗,用湿布擦试后,铝片上附着了液态银白色的物质。将该铝片静置一段时间,铝片表面长出白色须状物,手持铝片时,白色须状物脱落,铝片发烫。经实验白色须状物能溶于稀盐酸且无气体放出。试写出直接导致铝片发烫的热化学反应方程式:
⑶镁条投入5mL
0.5mol/LCuSO4溶液,其表面立即有气泡产生,周围有红色固体出现,片刻后底部又有大量蓝色沉淀生成;待较长时间后,若镁条过量,蓝色固体消失,有白色沉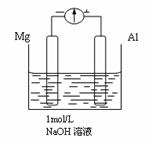 淀生成,气泡继续产生,而红色质量没有明显增加。写出反应中的全部离子反应方程式:
淀生成,气泡继续产生,而红色质量没有明显增加。写出反应中的全部离子反应方程式:
⑷剪取大小、表面积相近的约8cm长的镁条及铝片,用砂纸打
磨干净,使镁条与铝片分别与量程为500霾的教学电表的“-、
+”端相连接,迅速将两电极插入盛有1mol/LnaOH溶液的烧
杯中(如图)。预期的实验现象为:铝片溶解,镁条上有许多
气泡。然而实验事实是:开始,电表指针向右偏移约500霾,铝片表面有许多气泡,很快电流逐渐减小到约400霾,此时,铝片表面气泡有友减少,但镁条表面只有少量的气泡产生。请写出镁片上的电极反应式:
⑸常温下,在经过砂纸打磨的铝片上取两片质量相等,表面积相同的铝片,
分别加入到盛有体积相同、C(H+)相同的稀硫酸和稀盐酸溶液的两支试管(相同体积)中,发现铝片在稀盐酸中产生氢气的速率比在稀硫酸中快。
①写出以上反应的离子方程式:
②你认为出现以上现象的可能原因是:
假设a:
假设b:
③请设计实验对以上的假设进行验证:
④如果上述假设都成立,要使以上稀硫酸与铝反应产生的氢气速率加快,可以采取的措施有:(至少四种)
|
编号 |
措施 |
|
1 |
|
|
2 |
|
|
3 |
|
|
4 |
|
专题十八有关化学与社会、能源、环境的专题训练课后作业:
2、进一步强化基本解题技能,提高学生综合运用知识的能力。
[经典题型]
题型一:化学与环境
改善空气质量,保持空气清新,营造健康舒适的生存环境,已成为全人类的共识。
(1)下面是我国某地区第一份空气质量预报表。
|
指 标 |
昨 日 实 况 |
今 日 预 测 |
||
|
API |
空气质量等级 |
API |
空气质量等级 |
|
|
总悬浮颗粒物 |
26 |
Ⅰ |
20-35 |
Ⅰ |
|
二氧化硫 |
38 |
Ⅰ |
30-45 |
Ⅰ |
|
氮氧化物 |
59 |
Ⅱ |
55-75 |
Ⅱ |
|
说 明 |
预计今日空气质量较好,对人体无不利影响,市民可正常活动。 |
①试简述空气质量预报对有关部门和普通市民各有哪些指导意义?
对有关部门 ,
对普通市民 。
②二氧化硫是污染大气的主要有害物质之一。除去SO2的方法有多种,其中有一种方法叫“石灰石脱硫”法,原料为石灰石,产品为石膏。请写出相关的化学方程式: 。
(2)一氧化碳也是常见的大气污染物。汽油在汽车发动机中的不完全燃烧可表示为
2C8H18+23O2 12CO2+4CO+18H2O
12CO2+4CO+18H2O
①某环境监测兴趣小组的同学描绘的无锡市市中心地区空气中CO含量变化曲线(横坐标表示北京时间0到24小时,纵坐标表示CO含量),你认为比较符合实际的是( )
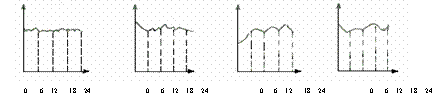
A B C D
②为了解决机动车污染空气的问题,你有何建议?(提2条)
(3)据《南京零距离》报道,有一公司刚开张几天,员工却全体出现中毒症状,但空气
检测部门检测各项指标均合格。专家发现是地毯出了问题。原来地毯厂为了防止地毯中甲醛超标,先用漂白粉对地毯进行了处理,结果消除了甲醛却放出了氯气。请你写出该过程的离子方程式 。
题型二:化学与能源
科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的
动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源
可持续利用的制氢气的方法是
A.电解水 B.锌和稀硫酸反应 C.光解海水 D.以石油、天然气为原料
(2)用氢作为能源亟待解决的又一问题是贮氢材料的开发,研究表明某些过渡金属镧
(La)、钯(Pd)能与氢原子形成氢化物,氢原子填充在金属晶体内的间隙之间,其组成不固
定,通常是非化学计量的,如镧的氢化物的化学式可表示为LaH2.76 。已知钯粉的密度为
27. (14分)已知:
|


|




 R-CH2-C-CH2-R’
R-CH2-C-CH2-R’
|
|
|
|
 O
O
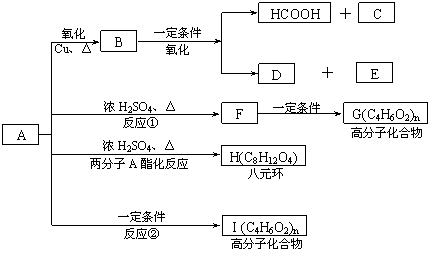 现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
现将A进行如下图所示反应,已知:D的相对分子质量比E小,B不能发生银镜反应,F可使溴水褪色,且其中含甲基。
试回答下列问题:
(1)写出下列物质的结构简式:A____________C____________D____________。
(2)反应①和②的反应类型:反应①____________ 反应②____________
(3)写出下列变化的化学方程式:
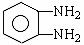 ①E与邻苯二胺(
)缩聚生成一种合成纤维:
①E与邻苯二胺(
)缩聚生成一种合成纤维:
②F→G_________________________________________________
③A→H_________________________________________________
 (4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的分子式
。近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是
。
(4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的分子式
。近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是
。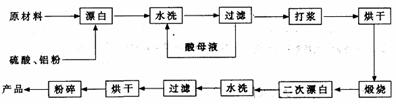 重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。
重晶石矿(主要成分为硫酸钡)因为含有Fe2O3、MnO及炭质等杂质而常呈深褐色。工业上将重晶石矿粉碎后与硫酸、铝粉在反应槽中混合加热(即“漂白”),再经水洗等一系列工序制得白色的重晶石填料,广泛用作纸张、油漆等的填充剂。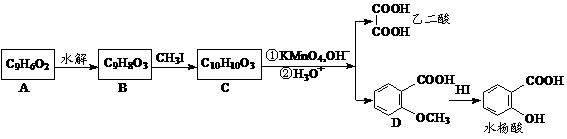
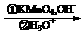 CH3COOH+CH3CH2COOH
CH3COOH+CH3CH2COOH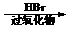 R-CH2-CH2-Br
R-CH2-CH2-Br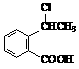 合成
合成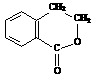 (用反应流程图表示,并注明反应条件)
(用反应流程图表示,并注明反应条件)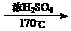 CH2=CH2
CH2=CH2