31.(2006惠州一模)某结晶水合物含有两种阳离子和一种阴离子。称取质量为1.96 g的该结晶水合物,配成溶液。加入足量Ba(OH)2溶液并加热该混合物,生成白色沉淀,随即沉淀变为灰绿色,最后变成红褐色,标况下产生224 mL能使湿润的红色石蕊试纸变蓝的气体;将沉淀过滤、洗涤并灼烧至恒重,得到固体粉末2.73 g;用足量稀盐酸处理上述粉末,洗涤和干燥后得到白色固体2.33 g。
请回答:
(1)该结晶水合物含有的两种阳离子是__________和__________,阴离子是__________。
(2)试通过计算确定该结晶水合物的化学式。
32(06全国理综I 28)(15分)
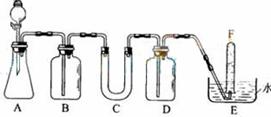
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的学化试剂和实验用品。用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。写出A中发生反应的化学方程式 _______________________________
⑵填写表中空格
|
仪器 |
加入试剂 |
加入试剂的目的 |
|
B |
饱和NaHCO3溶液 |
|
|
C |
|
|
|
D |
|
|
⑶.写出过氧化钠与二氧化碳反应的化学方程式_______________________________
⑷.试管F中收集满气体后,下一步实验操作是_______________________________
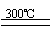 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅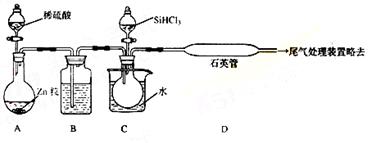
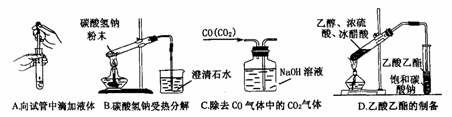 (2)下列实验没有错误的是
(2)下列实验没有错误的是
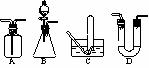 ①能用于干燥二氧化硫气体的装置有________(填字母)。
①能用于干燥二氧化硫气体的装置有________(填字母)。 则X气体可能是 [ ]
则X气体可能是 [ ]  .如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,
.如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,