1.原子核对核外电子的吸引力 2.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ/mol)
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7296 |
4570 |
1820 |
|
失去第三个电子 |
11799 |
6920 |
2750 |
|
失去第四个电子 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。 。
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
答案:(1)①④
(2)①Li原子失去1个电子后形成稳定结构,再失去1个电子很困难
②a Na2O或Na2O2
③ⅢA族或第三主
④m
解析:(1)从所给元素在周期表中的位置不难知道a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区也一定为金属,它们都是电的良导体;h为碳元素,其单质中的一种石墨也是电的良导体,故应选①、④两组。
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息2可知,要使锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量。
②由表中数据可知:X失去第2个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的2倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层。结合所给的周期表知,X应为a即钠元素和j即氧元素所形成的化合物化学式分别为Na2O和Na2O2。
③由表中所给Y的数据可知,Y失去第1、2、3个电子所需能量差别不大,而失去第4个电子所需能量远大于失去第3个电子所需的能量,因此Y元素的最外层有3个电子即为第ⅢA族的元素Al。
④从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-的稳定结构,因此失去核外第一个电子需要的能量最多。
[方法归纳]
3.以上知识是高考必考内容,常以选择题、简答题和推断填空题的形式出现。
[典型例题]
[例1]例1(2003上海理综)在人体所需的16种微量元素中有一种被称为生命元素的R 元素,对延长人类寿命起着重要的作用。已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称
A. 硫 B. 砷 C. 硒 D. 硅
[备选1]:周期表前20号元素中,某两种元素的原子序数相差1,它们形成化合物时,原子数之比为1﹕2,写出这些化合物的化学式______________
[备选2]:X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化学式不可能是
A. XYZ B.X2YZ C.X2YZ2 D.X3YZ3
[例2]下列有关物质的性质比较正确的是
(1) 同主族元素的单质从上到下,非金属性减弱,熔点增高
(2) 元素的最高正化合价在数值上等于它所在的族序数
(3) 同周期主族元素的原子半径越小,越难失去电子
(4) 元素的非金属性越强,它的气态氢化物水溶液的酸性越强
(5) 还原性:S2->Se2->Br->Cl-
(6) 酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.(1)(3) B.(2)(4) C.(3)(6) D.(5)(6)
[备选1]下表是X、Y、Z三种元素的氢化物的某些性质:
|
元素 |
熔点/℃ |
沸点/℃ |
与水的反应 |
导电性(纯液体) |
|
X |
-283 |
-162 |
不反应 |
不导电 |
|
Y |
-102 |
19 |
放热反应,形成酸性溶液 |
不导电 |
|
Z |
680 |
/ |
剧烈反应,生成H2,并形成碱性溶液 |
导电 |
若X、Y、Z这三种元素属于周期表中的同一周期,则它们的原子序数递增的顺序是
A. X、Y、Z B. Z、X、Y C. Y、X、Z D. Z、Y、X
[例3] (2003上海)下表是元素周期表的一部分,表中所列的字母分别表示一种化学元素。
|
b |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
j |
|
|
|
a |
c |
|
|
|
|
|
|
|
|
|
|
f |
|
i |
|
l |
m |
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)下列 (填写编号)组元素可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
21.(10分)2007年3月,温家宝总理在十届人大五次会议上指出要大力抓好节能降耗、保护环境。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是 。
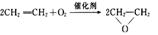 A.制备环氧乙烷:
A.制备环氧乙烷:

 B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
B.制备硫酸铜:Cu+2H2SO4
CuSO4+SO2↑+2H2O
C.制备甲醇: 2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的方程式为 ,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是 。
(3)工业上目前使用两种方法制取乙醛--“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料、反应条件、原料平衡转化率和产量等的有关信息:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
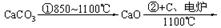 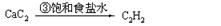 |
|
乙烯 |
来源于石油裂解气 |
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析 。
②从环境保护和能耗角度分析 。

 (10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。
(10分)24.(10分)如右下图所示两个等体积的容器,A为恒压容器,B为恒容容器。在相同温度下,分别将1 mol N2 和3 mol H2 混合气体充入A、B容器中,发生如下反应:N2(g)+3 H2 (g) 2NH3
(g); △H=-92.4 kJ/mol 。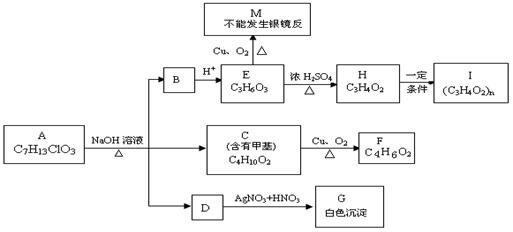 (10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:
(10分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2molCu2O。分析图表并回答问题:

 B
C
……
G
B
C
……
G 