35、原创(21分)工业上一般在恒容密闭容器中用H2和CO生产燃料甲醇,反应方程式为
CO(g)+2H2(g)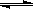 CH3OH(g)△H
CH3OH(g)△H
(1)下表所列数据是反应在不同温度下的化学平衡常数(K)。
|
温度 |
250°C |
300°C |
350°C |
|
K |
2.041 |
0.270 |
0.012 |
①由表中数据判断△H 0(填“>”、“=”或“<“)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得
c(CO)=0.2mol/L,则CO的转化率为 ,此时的温度为 。
(2)在100℃ 压强为0.1 MPa条件下,容积为V L某密闭容器中a mol CO与 2a mol H2在催化剂作用下反应生成甲醇,达平衡时CO的转化率为50%,则100℃该反应的的平衡常数K= (用含a、V的代数式表示并化简至最简单的形式)。此时保持温度容积不变,再向容器中充入a mol CH3OH(g),平衡_____(向正反应方向、向逆反应方向)移动,再次达到新平衡时,CO的体积分数 。(减小、增大、不变)
(3)要提高CO的转化率,可以采取的措施是 。
A.升温 B.加入催化剂 C.增加CO的浓度
D.恒容充入H2 E.恒压充入惰性气体 F.分离出甲醇
(4)判断反应达到平衡状态的依据是(填字母序号,下同) 。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(5)300°C,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡的有关数据如下:
|
容器 |
甲 |
乙 |
丙 |
|
|
反应物投入量 |
1molCO、2moL H2 |
1molCH3OH |
2molCH3OH |
|
|
平 衡 时 的 数 据 |
CH3OH浓度(mol/L) |
c1 |
c2 |
c3 |
|
反应的能量变化 |
akJ |
bkJ |
ckJ |
|
|
体系压强(Pa) |
p1 |
p2 |
p3 |
|
|
反应物转化率 |
α1 |
α2 |
α3 |
请选择正确的序号填空(不定项选择)
① c1、c2、c3的关系表达正确的为______
A c3>2c1 B c1<c3<2c1 C c1=c2
② a、b、c的关系表达正确的为________
A c<2|△H| B a+b=|△H| C c=2b
③ p1、p2、p3的关系不正确的为________
A p1=p2 B p2<p3<2p2 C p3>2p2
④ a1、a2、a3的关系表达不正确的为________
A a1=a2 B a3< a2 C a1+a2=1
2010-2011学年度第二学期期末
34、(13分)
Ⅰ 某温度下,密闭容器中充入1 mol N2和3 mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75 mol, 则y=________, z=________.
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是_______________________.
Ⅱ 一定条件下,可逆反应X(g)+Y(g) 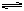 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) =0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________
____, a的取值范围为_______________
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y) =0.1 mol /L ; c (Z)=1.6 mol /L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是________
____, a的取值范围为_______________
Ⅲ 在10℃和4×105Pa的条件下,当反应aA(g)  dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
|
压强(Pa) |
4×105 |
6×105 |
10×105 |
20×105 |
|
D的浓度(mol/L) |
0.085 |
0.126 |
0.200 |
0.440 |
(1)压强从4×105Pa增加到6×105Pa时,平衡向 (填“正”或“逆”)方向移动,理由是_________________________________________________________________
(2)压强从10×105Pa增加到20×105Pa时,平衡向_______(填“正”或“逆”)方向移动
32、(12分)
现有10种元素的性质、数据如下表所列,它们均为短周期元素。
|
|
A |
B |
C |
D |
E |
F |
G |
H |
I |
J |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
0.82 |
0.102 |
0.037 |
|
最高或最低 化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
+3 |
+6 |
+1 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
|
-2 |
|
回答下列问题:
(1)D的元素名称是 ,
H的元素符号是 。
B在元素周期表中的位置是(周期、族)
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是 。
化合物F2A2的电子式是: ,构成该物质的化学键类型为________________
(3)用电子式表示A的简单氢化物的形成过程如下: ;
G的氢化物的结构式为 。
(4)一定条件下,IA2气体与足量的A单质充分反应生成20g气态化合物,放出24.6 kJ热量,写出其热化学方程式 。
(5)用J元素的单质与A元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入J的单质,乙极通入A的单质,则甲极的电极反应式为:____________________。