10.有失去标签的硝酸钾、碳酸钠、硝酸银、硝酸钙和稀盐酸五瓶溶液,将其任意编号:A、B、C、D、E,进行两两混合实验,其现象如下:
|
实验 |
A+B |
A+E |
B+C |
B+E |
|
现象 |
产生沉淀 |
产生沉淀 |
产生沉淀 |
产生气泡 |
(1)试推断并写出五种溶液中溶质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)写出有关反应的化学方程式:
A+E________________________________________________________________________。
B+E________________________________________________________________________。
答案:(1)AgNO3 Na2CO3 Ca(NO3)2 KNO3 HCl
(2)AgNO3+HCl====AgCl↓+HNO3 Na2CO3+2HCl====2NaCl+H2O+CO2↑
7.(2010江苏南通中考,24) 我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
(1)从表中数据可以看出,温度对____________的溶解度影响不大。
(2)要使NH4Cl饱和溶液中的NH4Cl结晶析出,在____________(填“较高”或“较低”)温度下进行比较合适。
|
|
0 ℃ |
20 ℃ |
40 ℃ |
60 ℃ |
|
NaHCO3 |
6.9 |
9.6 |
12.7 |
16.4 |
|
NaCl |
35.7 |
35.8 |
36.6 |
37.3 |
|
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
(3)“侯氏制碱法”制NaHCO3的方程式是NaCl+CO2+NH3+H2O====NaHCO3+NH4Cl,该反应能进行的原因是________________________________________________。
解析:从表中可以看出,温度对NaHCO3和NH4Cl的溶解度的影响都比较大,对NaCl的溶解度影响不大;随着温度的升高,水中可溶解的NH4Cl的质量变大,可以通过在较高温度下配置NH4Cl的饱和溶液,然后再降温结晶析出NH4Cl的办法将NH4Cl从溶液中分离出来;NaCl+CO2+NH3+H2O====NaHCO3+NH4Cl这个反应能够进行是因为NaHCO3在水中的溶解度较小,可以结晶析出。
答案:(1)NaCl (2)较低 (3)有溶解度较小的NaHCO3产生
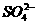 ,因此白色固体中肯定不含Na2SO4和CuSO4;沉淀加入稀盐酸放出能使石灰水变浑浊的无色气体,说明沉淀中含有
,因此白色固体中肯定不含Na2SO4和CuSO4;沉淀加入稀盐酸放出能使石灰水变浑浊的无色气体,说明沉淀中含有 ,而只有Na2CO3中含有
,而只有Na2CO3中含有