8.工业上用电解氧化铝的方法制取单质铝的化学方程式为:2Al2O3 4Al+3O2。对“电解10 kg氧化铝最多可生产多少千克铝?”一题,小明和小亮两位同学分别采用了两种不同的计算方法。
4Al+3O2。对“电解10 kg氧化铝最多可生产多少千克铝?”一题,小明和小亮两位同学分别采用了两种不同的计算方法。
|
小明同学的解法 |
小亮同学的解法 |
|
解:设铝的质量为X。 2Al2O3  4Al+3O2 4Al+3O2204 108 10 kg ?X? 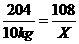 X=5.3 kg 答:最多可生产5.3 kg铝。 |
解:氧化铝中铝元素的质量分数: ×100% ×100%=  ×100% ×100%=53% 铝的质量为:10 kg×53%=5.3 kg 答:最多可生产5.3 kg铝。 |
请你完成下列下列问题:
(1)你认为他们的解题思路和方法都正确吗?
(2)对“34 kg过氧化氢完全分解可产生多少克氧气?”一题,你认为也能用上述两种方法解答吗?试试看,请把你用的解法过程写出来。
思路解析:小明同学是根据化学方程式进行计算的,小亮同学是根据在化学反应前后氧元素的质量相等来做的,所以他们的解题思路是正确的。对“34 kg过氧化氢完全分解可产生1多少克氧气?”一题,可以用小明同学的做法根据化学方程式的计算来做,但不能用小亮同学的做法,因为过氧化氢中的氧元素并没有全部转变成氧气。
答案:(1)他们的解题思路和方法都正确。
(2)16 kg
7.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的含量,取来了一些矿石样品,并取稀盐酸200 g,平均分成4份,进行实验。
|
实验 |
1 |
2 |
3 |
4 |
|
加入样品的质量/g |
5 |
10 |
15 |
20 |
|
生成CO2的质量/g |
1.76 |
3.25 |
4.4 |
M |
(1)哪几次反应矿石有剩余?_______________。
(2)上表中M的数值是____________。
(3)试计算这种石灰石中碳酸钙的质量分数。
思路解析:第一次实验中样品全部反应,盐酸有剩余,第二次实验中样品也全部反应,盐酸仍有剩余,因为反应的样品质量与生成二氧化碳的质量对应成比例,在第三次实验中如果15 g样品全部参加反应,会生成1.76 g×3=5.28 g二氧化碳,实际上只生成了4.4 g。这说明样品没有全部反应,有剩余,则盐酸全部反应生成4.4 g二氧化碳。在第四次实验中,盐酸也全部反应,生成4.4 g二氧化碳。
解:设5 g石灰石中碳酸钙的质量为X。
CaCO3+2HCl====CaCl2+H2O+CO2
100 44
X ?1.76 g
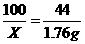 X=4
g 4 g÷5 g=80%
X=4
g 4 g÷5 g=80%
答案:(1)第一、二次 (2)4.4 g (3)80%
我创新 我超越
6.图5-3是分析一种化合物组成的实验装置。
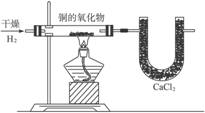
图5-3
实验结果如下:
|
|
实验前 |
实验后 |
|
铜的氧化物+玻璃管 |
137.8 g |
131.4 g |
|
氯化钙+U形管 |
100.8 g |
108.0
g |
注:玻璃管质量为80.2 g。
试根据实验数据求:
(1)完全反应后生成水的质量为_______g。
(2)生成的水中氧元素的质量为_______g。
(3)铜的氧化物中铜元素的质量为_______g。
(4)铜的氧化物中铜元素和氧元素的质量比为_______。
(5)铜的氧化物中铜、氧原子个数的最简整数比为_______(已知铜和氧的相对原子质量分别为64和16);
(6)写出铜的氧化物的化学式:____________________________。
思路解析:(1)完全反应后生成的水的质量为:108.0 g-100.8 g=7.2 g。
(2)生成的水中氧元素的质量为:137.8 g-131.4 g=6.4 g。
(3)铜的氧化物中铜元素的质量为:137.8 g-80.2 g-6.4 g=51.2 g。
(4)铜的氧化物中铜元素和氧元素的质量比为:51.2 g∶6.4 g=8∶1。
(5)铜的氧化物中铜、氧原子个数的最简整数比为:(8∶1)/(64∶16)=2∶1。
(6)铜的氧化物的化学式:Cu2O。
答案:(1)7.2 (2)6.4 (3)51.2 (4)8∶1 (5)2∶1 (6)Cu2O