摘要:演示实验: 现象:紫色的石蕊试液变红色.加热后红色又变成紫色 提示:酸性物质能使紫色的石蕊试液变红色 说明:二氧化碳溶解于水中时生成了酸性物质--碳酸,碳酸不稳定.受 热易分解.又生成二氧化碳和水 反应式: 二氧化碳+水碳酸 CO2 H2O H2CO3 碳酸二氧化碳+水 H2CO3 CO2 H2O
网址:http://m.1010jiajiao.com/timu3_id_97479[举报]
化学课堂上老师演示了如下图所示的几个实验:
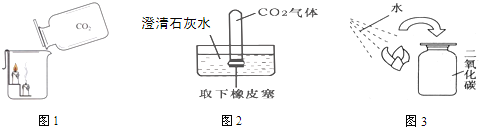
(1)图1中下层蜡烛先熄灭,上层蜡烛后熄灭,据此说明二氧化碳的性质有:①
(2)图2所示实验中,应观察到的实验现象是
①试管变瘪 ②试管内液面上升
③试管内液体变浑浊 ④试管内液体变红
(3)图3所示实验中,
查看习题详情和答案>>

(1)图1中下层蜡烛先熄灭,上层蜡烛后熄灭,据此说明二氧化碳的性质有:①
不燃烧也不支持燃烧
不燃烧也不支持燃烧
; ②密度比空气大
密度比空气大
;(2)图2所示实验中,应观察到的实验现象是
②③
②③
(填序号);①试管变瘪 ②试管内液面上升
③试管内液体变浑浊 ④试管内液体变红
(3)图3所示实验中,
H2CO3
H2CO3
(填物质的化学式)使紫色干花(用石蕊溶液浸泡过)变红.化学课堂上老师演示了如下图所示的几个实验:

(1)图1中下层蜡烛先熄灭,上层蜡烛后熄灭,据此说明二氧化碳的性质有:①______; ②______;
(2)图2所示实验中,应观察到的实验现象是______(填序号);
①试管变瘪 ②试管内液面上升
③试管内液体变浑浊 ④试管内液体变红
(3)图3所示实验中,______(填物质的化学式)使紫色干花(用石蕊溶液浸泡过)变红.
查看习题详情和答案>>
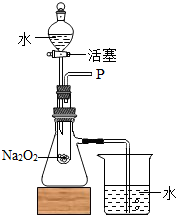 (2013?德宏州)某同学在表演完“水能生火”的魔术后解释说:“该魔术是向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱胎棉就能燃烧起来.”小红听完后以这个“魔术”非常感兴趣,她和同学们一起对该问题进行了探究.
(2013?德宏州)某同学在表演完“水能生火”的魔术后解释说:“该魔术是向包有淡黄色过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱胎棉就能燃烧起来.”小红听完后以这个“魔术”非常感兴趣,她和同学们一起对该问题进行了探究.[提出问题]过氧化钠与水反应生成了什么物质?脱脂棉为什么会燃烧?
[作出猜想]①产生了支持燃烧的氧气,②反应过程中可能产生大量的热
[设计装置]如图所示
[实验探究]
实验一:探究反应后生成的气体是什么?
(1)打开如图装置中分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃.说明生成的气体是
氧气
氧气
;(2)实验中,还观察到伸入烧杯中的导管口有气泡冒出,请解释产生该现象的原因
过氧化钠和水反应是放热反应
过氧化钠和水反应是放热反应
.实验二:待过氧化钠完全反应后看到有白色固体出现,探究该生成物是什么?
(1)小张猜想该生成物是Na2CO3,小军则认为该生成物是NaOH,他们为了验证各自的猜想设计了如下所示实验,请你参与并补充完整.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取由白色固体配制成的溶液少许于试管中,加入过量的稀盐酸 | 没有气泡产生 | 生成物中 无碳酸钠 生成物中 无碳酸钠 |
| ②再取由白色固体配制成的溶液少许于试管中,加入适量的CuCl2溶液 | 生成蓝色沉淀 生成蓝色沉淀 |
生成物为NaOH |
红
红
色,如果滴入的是紫色石蕊试液,则石蕊试液变蓝
蓝
色.[得出结论]由实验探究的结果,写出过氧化钠和水反应的化学方程式
2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
.(1)如图1,A、B、C三个实验用于验证质量守恒定律:

①实验C中,烧杯中看到的现象是________;
②其中不能达到实验目的是________,理由是________.
(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:________;
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是________,说明试管中的剩余固体为________;
b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是________.
(3)如图是探究酸碱中和的实验:

小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
②请分析错误方案的原因:________. 查看习题详情和答案>>
(1)如图1,A、B、C三个实验用于验证质量守恒定律:
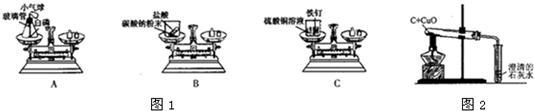
①实验C中,烧杯中看到的现象是______;
②其中不能达到实验目的是______,理由是______.
(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:______;
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是______,说明试管中的剩余固体为______;
b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是______.
(3)如图是探究酸碱中和的实验:
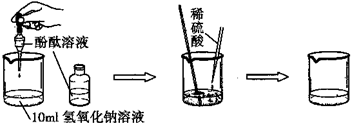
小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
①设计的三个方案中,正确的方案是:______;
②请分析错误方案的原因:______.
查看习题详情和答案>>

①实验C中,烧杯中看到的现象是______;
②其中不能达到实验目的是______,理由是______.
(2)如图2是“用木碳还原氧化铜”的演示实验,请回答下列问题:
①写出用木碳还原氧化铜的化学方程式:______;
②反应进行一段时间后,为了探究试管中剩余固体的组成,待试管冷却到室温后,取剩余固体于烧杯中,再加入过量稀硫酸,充分搅拌后过滤.
a.若滤纸上留有黑色、红色固体,而滤液为无色,则滤液中的溶质是______,说明试管中的剩余固体为______;
b.若滤纸上留有黑色、红色固体,而滤液呈蓝色,此时滤液中的溶质是______.
(3)如图是探究酸碱中和的实验:

小丽同学为探究上述反应后烧杯中的硫酸是否过量,选取BaCl2、锌粒、紫色石蕊等三种药品和试剂来设计实验,请你根据下表判断出正确的实验方案及分析错误方案的出错原因:
| 实验方案 | 实验步骤 | 实验现象 | 实验结论 |
| 方案一 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
| 方案二 | 取样,放入几粒锌粒 | 溶液中产生气泡 | 硫酸过量 |
| 方案三 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
②请分析错误方案的原因:______.