网址:http://m.1010jiajiao.com/timu3_id_94664[举报]
 氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.
氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的________(填“开头”、“中间”或“结尾”).
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是________(填离子符号).
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为________.
Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易________,因此它与生石灰一起用作某些气体的干燥剂
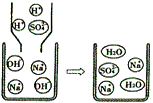
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为________.
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的________.
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究.
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是________(用方程式表示);
猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验________ (填“能”或“不能”)说明猜想Ⅱ成立.
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是________.
(4)定量研究:根据上述实验,可通过测定________,再通过计算得到氢氧化钠的变质情况. 查看习题详情和答案>>
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”).
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号).
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 .
Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 .
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 .
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究.
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);
猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立.
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 .
(4)定量研究:根据上述实验,可通过测定 ,再通过计算得到氢氧化钠的变质情况.
 查看习题详情和答案>>
查看习题详情和答案>>
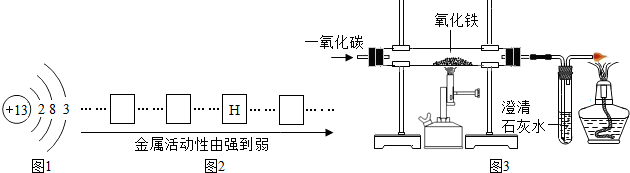
①人类进入铁器时代要比青铜器时代晚得多,这与
A.金属的活动性 B.金属的导电性 C.金属的导热性 D.地壳中金属元素的含量
②人类一般使用铜合金多于纯铜,因为铜合金的熔点要比铜低,硬度要比铜
(2)金属的结构
图1是铝的原子结构示意图.在化学反应中铝原子易
(3)金属的活动性
①请将铜、铝、铁三种金属的元素符号填写在下列金属活动性顺序图2中的相应位置.
②要快捷验证铜、铝、铁的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的其它试剂是
③镁、铝、铁三种金属单质与足量的稀硫酸反应,生成等质量的氢气,需要消耗的金属质量由多到少的顺序是
(4)金属的锈蚀
①铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性能,其原因是
②铁在潮湿的空气中容易锈蚀,为了防止铁制品锈蚀,人们常采用
③铜表面也容易生锈成铜绿,其主要成分是碱式碳酸铜[Cu2(OH)2CO3].铜生锈除了与氧气和水有关外,还与空气中的
(5)金属的冶炼
①西汉时期我国的劳动人民又发明了“湿法炼铜”,即“曾青得铁则化为铜”请用反应方程式表示其冶炼原因
②小章同学准备在实验室用图3所示装置模拟工业炼铁.请你据此回答:
实验中玻璃管内的现象为:
| ||
| ||
③某同学实验完成后,发现过量的澄清石灰水增重0.88g,则该同学通入装置的CO气体质量一定要大于
氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题。
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”)。
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号)。
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 。Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 。
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 。
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);猜想Ⅲ:全部变质
【实验设计、现象和推断】
| 实验步骤 | 实验现象 |
| ①取少量白色固体于试管中,加水振荡后,至全部溶解 | 无色溶液 |
| ②向试管的溶液中滴加适量物质X的溶液 | 现象A |
| ③再向试管中滴加几滴酚酞试液. | 现象B |
(1)若现象A为有气泡产生,则加入的X溶液是 ,说明猜想 可排除。
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立。
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 。
(4)定量研究:根据上述实验,可通过测定 ,
再通过计算得到氢氧化钠的变质情况。
 查看习题详情和答案>>
查看习题详情和答案>>
氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题。
Ⅰ.结构:
NaOH含有钠元素,钠在元素周期表中处于第三周期的 (填“开头”、“中间”或“结尾”)。
NaOH属于碱,碱在溶液中都可以电离出相同的离子,该离子是 (填离子符号)。
Ⅱ.制备:
实验室用纯碱制备烧碱的化学反应方程式为 。Ⅲ.性质及变化:
(1)氢氧化钠固体曝露在空气中容易 ,因此它与生石灰一起用作某些气体的干燥剂
(2)如右图所示,NaOH溶液可与稀酸反应的方程式为 。
该反应没有明显的现象,为了说明该反应确实能够发生,下列哪种物质肯定无法帮助你达到目的 。
a.镁条 b.酚酞 c.CuSO4 d.Ba(NO3)2
Ⅳ.保存:
张老师整理药品时,意外发现实验桌上有瓶敞口放置的NaOH固体,他让同学们对这瓶NaOH固体进行探究
【提出猜想】
猜想I:没有变质
猜想Ⅱ:部分变质为Na2CO3,依据是 (用方程式表示);猜想Ⅲ:全部变质
【实验设计、现象和推断】
|
实验步骤 |
实验现象 |
|
①取少量白色固体于试管中,加水振荡后,至全部溶解 |
无色溶液 |
|
②向试管的溶液中滴加适量物质X的溶液 |
现象A |
|
③再向试管中滴加几滴酚酞试液. |
现象B |
(1)若现象A为有气泡产生,则加入的X溶液是 ,说明猜想 可排除。
(2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色变红色,该实验 (填“能”或“不能”)说明猜想Ⅱ成立。
(3)若X是CaCl2溶液,则猜想Ⅱ成立的实验现象是 。
(4)定量研究:根据上述实验,可通过测定 ,
再通过计算得到氢氧化钠的变质情况。

查看习题详情和答案>>