摘要:第一个对空气组成进行探究的化学家:拉瓦锡(第一个用天平进行定量分析).
网址:http://m.1010jiajiao.com/timu3_id_93953[举报]
某化学兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.
(一)首先,他们分组进行讨论:
(1)第1组认为,药品的选择对实验的成败是一个关键.就铁丝、木炭、红磷这三种药品中,最理想应选择 ,不选择另外两种的原因是: .
(2)第4组认为,为了充分消耗容器中的氧气,药品的用量应保证 .
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
(1)通过对实验结果的交流,大多数组的同学都验证出氧气约占空气体积的 .只有第8组同学没能得到数据.原因是 .
(2)其中第三组同学的广口瓶内水面上升明显小于瓶内空气体积的
,第六组同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是 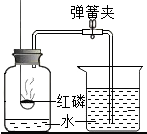
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A、只有①③B、只有③④C、只有①②③D、①②③④ 查看习题详情和答案>>
(一)首先,他们分组进行讨论:
(1)第1组认为,药品的选择对实验的成败是一个关键.就铁丝、木炭、红磷这三种药品中,最理想应选择
(2)第4组认为,为了充分消耗容器中的氧气,药品的用量应保证
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
| 组 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 集气瓶容积 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| 进入水的体积 | 4 | 3.5 | 4 | 4 | 4 | 4.5 | 4 | - |
(2)其中第三组同学的广口瓶内水面上升明显小于瓶内空气体积的
| 1 |
| 5 |

①甲同学可能使用红磷的量不足,瓶内氧气没有消耗
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A、只有①③B、只有③④C、只有①②③D、①②③④ 查看习题详情和答案>>
某化学兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.
(一)首先,他们分组进行讨论:
(1)第1组认为,药品的选择对实验的成败是一个关键.就铁丝、木炭、红磷这三种药品中,最理想应选择______,不选择另外两种的原因是:______.
(2)第4组认为,为了充分消耗容器中的氧气,药品的用量应保证______.
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
| 组 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 集气瓶容积 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| 进入水的体积 | 4 | 3.5 | 4 | 4 | 4 | 4.5 | 4 | - |
(2)其中第三组同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,第六组同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是______
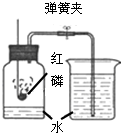
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A、只有①③B、只有③④C、只有①②③D、①②③④ 查看习题详情和答案>>
某化学兴趣小组想亲身感受科学家的探究历程,他们选择了《空气中氧气含量的粗略测定》为探究内容.
(一)首先,他们分组进行讨论:
(1)第1组认为,药品的选择对实验的成败是一个关键.就铁丝、木炭、红磷这三种药品中,最理想应选择 ,不选择另外两种的原因是: .
(2)第4组认为,为了充分消耗容器中的氧气,药品的用量应保证 .
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
(1)通过对实验结果的交流,大多数组的同学都验证出氧气约占空气体积的 .只有第8组同学没能得到数据.原因是 .
(2)其中第三组同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,第六组同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是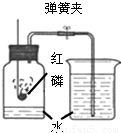
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A、只有①③B、只有③④C、只有①②③D、①②③④ 查看习题详情和答案>>
(一)首先,他们分组进行讨论:
(1)第1组认为,药品的选择对实验的成败是一个关键.就铁丝、木炭、红磷这三种药品中,最理想应选择 ,不选择另外两种的原因是: .
(2)第4组认为,为了充分消耗容器中的氧气,药品的用量应保证 .
(二)在充分讨论的基础上他们设计了实验.
(三)实验结束后,大家整理的实验数据如下:
| 组 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 集气瓶容积 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 |
| 进入水的体积 | 4 | 3.5 | 4 | 4 | 4 | 4.5 | 4 | - |
(2)其中第三组同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,第六组同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是

①甲同学可能使用红磷的量不足,瓶内氧气没有消耗
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A、只有①③B、只有③④C、只有①②③D、①②③④ 查看习题详情和答案>>
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
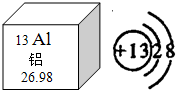
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.(1)①铝在地壳中的含量居所有金属元素的第
1
1
位,根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为13
13
,如图微粒结构示意图表示B
B
(填序号)A.铝原子 B.铝离子 C.铝分子
②工业上用电解氧化铝制取金属铝,同时生成一种常见的气体.反应的方程式为
2Al2O3
4Al+3O2↑
| ||
2Al2O3
4Al+3O2↑
.
| ||
③工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.化学反应方程式为
Al2O3+N2+3C
2AlN+3CO
| ||
Al2O3+N2+3C
2AlN+3CO
.
| ||
(2)铝合金比单质铝有着更为广泛的应用.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
[查阅资料]铝与氢氧化钠溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
[猜 想]猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有
铜
铜
.猜想3:该合金粉末中除铝外,还含有铁、铜.
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 铝 铝 . |
| ②取步骤①所得滤渣,加过量的 10%盐酸 10%盐酸 ,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 铁和铜 铁和铜 . |
[反 思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.等质量铝与足量盐酸反应生成的氢气比其与足量氢氧化钠溶液生成的氢气
A
A
(选填序号)A.多 B.少 C.相等 D.无法比较
(3)在烧杯中加入4.28g久置空气中的铝箔,再滴加稀盐酸,放出气体的质量与所加稀盐酸质量的关系如右图所示.请回答下列问题:
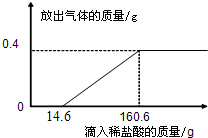
①产生氢气
0.4
0.4
g.②刚开始没有氢气放出的原因是铝箔表面有
致密
致密
(选填“致密”或“疏松”)的氧化层.氧化层与稀盐酸反应生成易溶于水的氯化铝和水,反应方程式为Al2O3+6HCl=2AlCl3+3H2O
Al2O3+6HCl=2AlCl3+3H2O
.③所滴加的稀盐酸中溶质的质量分数.
 铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
铝被称为“年轻的金属”,据世界化学史记载,金属铝是在1825年才被英国化学家戴维制得.今天,铝已经进入了我们生活的每一个角落.
(1)①铝在地壳中的含量居所有金属元素的第______位,根据铝元素在元素周期表中的“身份证”,铝元素的原子序数为______,如图微粒结构示意图表示______(填序号)
A.铝原子 B.铝离子 C.铝分子
②工业上用电解氧化铝制取金属铝,同时生成一种常见的气体.反应的方程式为______.
③工业上从铝土矿中获得氧化物X,从空气中获得氮气,再将物质X、N2和碳在一定条件下反应制得AlN和CO.化学反应方程式为______.
(2)铝合金比单质铝有着更为广泛的应用.已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
[查阅资料]铝与氢氧化钠溶液反应方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
[猜 想]猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有______.
猜想3:该合金粉末中除铝外,还含有铁、铜.
[实验探究]下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的30%NaOH溶液,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有______. |
| ②取步骤①所得滤渣,加过量的______,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有______. |
[反 思]一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.等质量铝与足量盐酸反应生成的氢气比其与足量氢氧化钠溶液生成的氢气______(选填序号)
A.多 B.少 C.相等 D.无法比较
(3)在烧杯中加入4.28g久置空气中的铝箔,再滴加稀盐酸,放出气体的质量与所加稀盐酸质量的关系如右图所示.请回答下列问题:

①产生氢气______g.
②刚开始没有氢气放出的原因是铝箔表面有______(选填“致密”或“疏松”)的氧化层.氧化层与稀盐酸反应生成易溶于水的氯化铝和水,反应方程式为______.
③所滴加的稀盐酸中溶质的质量分数. 查看习题详情和答案>>