网址:http://m.1010jiajiao.com/timu3_id_88504[举报]
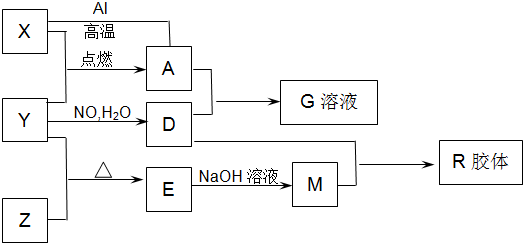
回答下列问题:
(1)A的化学名称是
(2)知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.现有A 与Al的混合物共304g用于干焊接,恰好反应,则应放出
(3)写出E和石灰石反应的化学方程式:
(4)向D的稀溶液中,加入过量的X粉末,假设生成的气体只有一种,写出有关反应的化学方程式

回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
(2)一定条件下,Z与H2反应生成ZH4,ZH4的电子式为


(3)已知A与1molAl反应转化为X时(所有物质均为固体).放出aKJ热量.写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:
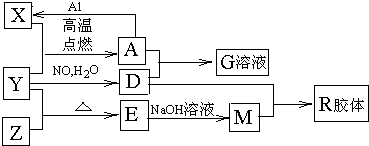
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是
(2)一定条件下,Z与H2反应转化为ZH4.ZH4的电子式为


(3)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式:
(4)写出A和D的稀溶液反应生成G的离子方程式:
 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O 9Fe3++NO↑+14H2O
9Fe3++NO↑+14H2O(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值.
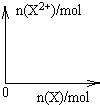
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁:E是不溶于水的酸性氧化物,能与氢氟酸反应。
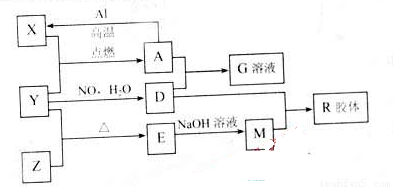
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
(2)一定条件下,Z与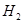 反应生成
反应生成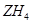 ,
,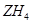 的电子式为
。
的电子式为
。
(3)已知A与1mol Al反应转化为X时(所有物质均为固体)。放出aKJ热量。写出该反应的热化学方程式:
。
(4)写出A和D的稀溶液反应生成G的离子方程式:
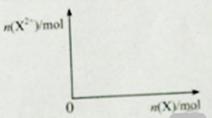
(5)问含4mol D 的稀溶液中,逐渐加入X3粉末至过量。假设生成的气体只有一种,请在坐标系中画出
n(X2-)随n(X)变化的示意图,并标出n(X2-)的最大值。
查看习题详情和答案>>
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。
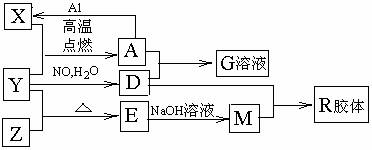
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 ;R的化学式是 。
⑵一定条件下,Z与H2反应转化为ZH4。ZH4的电子式为 。
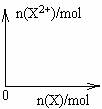 ⑶已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式: 。
⑶已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式: 。
⑷写出A和D的稀溶液反应生成G的离子方程式: 。
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。
查看习题详情和答案>>