摘要:11.下列晶体或粒子的空间结构不属于正四面体的是 ( ) ①二氧化硅 ②晶体硅 ③金刚石 ④甲烷 ⑤铵根离子 ⑥三氯甲烷 ⑦氨分子 A.①③⑤ B.②④⑥ C.⑥⑦ D.②⑤⑦ [解析] SiO2中存在硅.氧正四面体,晶体硅和金刚石均是正四面体形的空间网状结构的晶体,CH4.NH分别是正四面体形的分子.离子,CHCl3具有四面体结构.但不属于正四面体,NH3是三角锥形分子. [答案] C
网址:http://m.1010jiajiao.com/timu3_id_88059[举报]
下列对有关微粒结构的表示或说法不正确的是
- A.氮分子的电子式为::N:::N:
- B.氨分子的空间构型为三角锥型,属于极性分子
- C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
- D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:

①H、N、O三种元素的电负性由大到小的顺序是
②SO2分子的空间构型为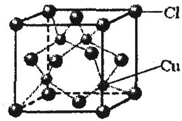
③乙二胺分子中氮原子轨道的杂化类型为
④(3)中所形成的配离子中含有的化学键类型有
a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
查看习题详情和答案>>
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:

①H、N、O三种元素的电负性由大到小的顺序是
O>N>H
O>N>H
.②SO2分子的空间构型为
V形
V形
.与SnCl4互为等电子体的一种离子的化学式为SO42-、SiO44-等
SO42-、SiO44-等

③乙二胺分子中氮原子轨道的杂化类型为
sp3杂化
sp3杂化
.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键
.④(3)中所形成的配离子中含有的化学键类型有
abd
abd
.a.配位键 b.极性键 c.离子键 d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为
4
4
.下列对有关微粒结构的表示或说法不正确的是 ( )
A.氮分子的电子式为: :N:::N:
B.氨分子的空间构型为三角锥型,属于极性分子
C. 白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子
D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同
查看习题详情和答案>>下列对有关微粒结构的表示或说法不正确的是 ( )
| A.氮分子的电子式为::N:::N: |
| B.氨分子的空间构型为三角锥型,属于极性分子 |
| C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子 |
| D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同 |
下列对有关微粒结构的表示或说法不正确的是 ( )
| A.氮分子的电子式为::N:::N: |
| B.氨分子的空间构型为三角锥型,属于极性分子 |
| C.白磷属于分子晶体,空间构型为正四面体,键角60°,是非极性分子 |
| D.NH4+离子中的四个N—H键虽然形成方式不同,但键能、键长、键角都相同 |