网址:http://m.1010jiajiao.com/timu3_id_85020[举报]
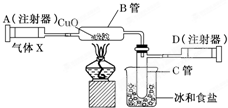
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。

在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。
查看习题详情和答案>>
如图所示的实验装置可用来测定含两种元素的某种气体X的分子式。
在注射器A中装有240 mL气体X并慢慢通过不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到以下实验结果:实验前B管重20.32 g,实验后B管重20.00 g,B管中的黑色粉末变成红色粉末。在C管中收集到的无色液体是水;在注射器D中收集到的气体是氮气。试回答下列问题:
(1)X气体是由________和________元素组成的。
(2)若240 mL X气体完全反应后,收集到的氮气质量是0.28 g。根据实验时温度和压强计算1 mol X气体的体积是24 000 mL,则X的摩尔质量是________。
(3)通过计算,确定X的分子式为________。
(4)写出B中发生反应的化学方程式(X在该条件下不发生分解反应)________________________。
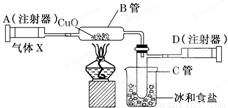
 如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:
如图所示的实验装置可用来测定含两种元素的某种气体x的分子式.在注射器A中装有240mL气体X慢慢通过 不含空气并装有红热的氧化铜的玻璃管B,使之完全反应,得到下面的实验结果:实验前B管重20.32g,实验后B管重20.00g,B管中的黑色粉末变成红色粉末.在C管中收集的无色液体是水;在注射器D中收集的气体是氮气.试回答下列问题:
(1)X气体是由______和______元素组成的.
(2)若240mLX气体完全反应后,收集到氮气的质量是0.28g.根据实验时的温度和压强计算1molX的气体的体积是24000mL,则X的摩尔质量是______g/mol.
(3)通过计算,确定x的分子式为______.
(4)写出B中发生反应的化学方程式(x在该条件下不发生分解反应)______.
查看习题详情和答案>>
(1)X气体是由______和______元素组成的.
(2)若240mLX气体完全反应后,收集到氮气的质量是0.28g.根据实验时的温度和压强计算1molX的气体的体积是24000mL,则X的摩尔质量是______g/mol.
(3)通过计算,确定x的分子式为______.
(4)写出B中发生反应的化学方程式(x在该条件下不发生分解反应)______ 2Cu+2H2O+N2
 查看习题详情和答案>>
查看习题详情和答案>>
(1)X气体是由______和______元素组成的.
(2)若240mLX气体完全反应后,收集到氮气的质量是0.28g.根据实验时的温度和压强计算1molX的气体的体积是24000mL,则X的摩尔质量是______g/mol.
(3)通过计算,确定x的分子式为______.
(4)写出B中发生反应的化学方程式(x在该条件下不发生分解反应)______ 2Cu+2H2O+N2
 查看习题详情和答案>>
查看习题详情和答案>>