网址:http://m.1010jiajiao.com/timu3_id_82595[举报]
(1)卤化氢中,HF的沸点高于HCl,原因是______.
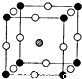
(2)如图所示为F-与Mg2+、K+形成的某种离子晶体的晶胞,其中“O”表示的离子是______(填离子符号).
(3)多卤化物Rb[ICl2]分解时生成晶格能相对较大的铷(Rb)的卤化物,则该卤化物的化学式为______.
(4)BF3与NH3,能发生反应生成X(H3BNF3),X的结构式为______(用“→”表示出配位键):X中B原子的杂化学式为______.
(5)有一类物质的性质与卤素类似,称为“拟卤素”[如(SCN)2、(CN)2等].(CN)2的结构式为N≡C-C≡N,该分子中σ键和π键数目之比为______.
 查看习题详情和答案>>
查看习题详情和答案>>
氯化硼(BN)晶体是一种新型无机合成材料。用硼砂(Na2B4O7)和尿素反应可以得到氮化硼:Na2B4O7+ 2CO(NH2)2=4BN+Na2O +4H2O+2CO2↑,根据要求回答下列问题:
(1)组成反应物的所有元素中,第一电离能最大的是___________________。
(2)尿素分子( )中
)中 键与
键与 键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
(3)尿素分子一定条件下形成六角形“超分子”(结构如图)。“超分子”中尿素分子间主要通过什么作用力结合。答:________________(填1种)。

(4)图示“超分子”的纵轴方向有一“通道”。直链烷烃分子刚好能进人通道,并形成“超分子”的包台物;支链烷烃因含有测链,空间体积较大而无法进入“通道”。利用这一性质可以实现直链烷烃和支链烷烃的分离。
①直链烷烃分子能进人通道时,通过什么作用力与“超分子”结合,从而形成 “超分子”包合物?答:___________________。
②下列物质可以通过尿素“超分子”进行分离的是____________。
A.乙烷和丁烷??? B.丁烷和异丁烷??? C.异戊烷和新戊烷??? D氯化钠和氯化钾
(5)BN晶体有a、B两种类型,且a—BN结构与石墨相似、B—BN结构与金刚石相似。
①a一BN晶体中N原子杂化方式是____________________;
②B—BN晶体中,每个硼原予形成________个共价键。这些共价键中,有________个为配位键。
查看习题详情和答案>>
(1)组成反应物的所有元素中,第一电离能最大的是___________________。
(2)尿素分子(
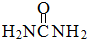 )中
)中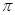 键与
键与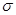 键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。
键数目之比为__________;尿素分子中处于同一平面的原子最多有_______个。(3)尿素分子一定条件下形成六角形“超分子”(结构如图)。“超分子”中尿素分子间主要通过什么作用力结合。答:________________(填1种)。

(4)图示“超分子”的纵轴方向有一“通道”。直链烷烃分子刚好能进人通道,并形成“超分子”的包台物;支链烷烃因含有测链,空间体积较大而无法进入“通道”。利用这一性质可以实现直链烷烃和支链烷烃的分离。
①直链烷烃分子能进人通道时,通过什么作用力与“超分子”结合,从而形成 “超分子”包合物?答:___________________。
②下列物质可以通过尿素“超分子”进行分离的是____________。
A.乙烷和丁烷 B.丁烷和异丁烷 C.异戊烷和新戊烷 D氯化钠和氯化钾
(5)BN晶体有a、B两种类型,且a—BN结构与石墨相似、B—BN结构与金刚石相似。
①a一BN晶体中N原子杂化方式是____________________;
②B—BN晶体中,每个硼原予形成________个共价键。这些共价键中,有________个为配位键。
物质结构与性质:
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:

回答下列问题:
(1)Mn元素价电子层的电子排布式为________,比较两元素的l2、l3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难.对此,你的解释是________;
(2)Fe原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是________;
②六氰合亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是________,写出一种与CN-互为等电子体的单质分子的路易斯结构式_________;
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为________;
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________.

已知A、B、c、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,S轨道电子数是P轨道电子数的两倍;D原子L层上有2对成对电子;E+原子核外有3层电子且M层3d轨道电子全充满.
请回答下列问题:
(1)E元素基态原子的电子排布式为
(2)B、C、D三种元素的第一电离能数值由小到大的顺序为
(3)D元素与氟元素相比,电负性:D
A.常温下氟气的颜色比D单质的颜色深
B.氟气与D的氢化物剧烈反应,产生D的单质
C.氟与D形成的化合物中D元素呈正价态
D.比较两元素的单质与氢气化合时得电子的数目
(4)离子化合物CA,的电子式为
A.极性键 B.非极性键C.配位键 D.金属键
(5)B2A4是重要的基本石油化工原料.B2A4分子中B原子轨道的杂化类型为