网址:http://m.1010jiajiao.com/timu3_id_82053[举报]
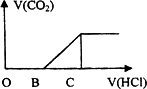
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解) ( )

A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3-
B.若OB=BC,则溶液M为Na2CO3溶液
C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看习题详情和答案>>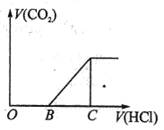
| A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3- |
| B.若OB=BC,则溶液M为Na2CO3溶液 |
| C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
| D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) |
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解)

- A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3-
- B.若OB=BC,则溶液M为Na2CO3溶液
- C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
- D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量的不同,溶液M的组成也不同,若向M中加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计CO2的溶解)
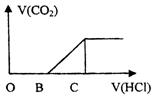
A.若OB=0,则形成溶液M所发生的离子方程式为OH-+CO2=HCO-3
B.若OB=BC,则溶液M为![]() 溶液
溶液
C.若OB>BC,则溶液M中大量存在的阴离子为![]() 和
和![]()
D.若30B=BC,则溶液M中![]()
|
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量的不同,溶液M的组成也不同,若向M中加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示,则下列分析与判断不正确的是(不计CO2的溶解)
| |
| [ ] | |
A. |
若OB=0,则形成溶液M所发生的离子方程式为OH-+CO2=HCO-3 |
B. |
若OB=BC,则溶液M为Na2CO3溶液 |
C. |
若OB>BC,则溶液M中大量存在的阴离子为CO |
D. |
若30B=BC,则溶液M中C(NaHCO3)=3C(NA2CO3) |