摘要:4.(2010×北京-黄冈预测卷三)A.B.C.D.E五种短周期元素的原子序数依次增大.元素A 的负一价离子具有和稀有气体He一样的结构.元素B的最外层电子数是内层电子总数的2 倍.元素C是短周期元素中原子半径最大的主族元素.元素D在地壳中的含量位于第二位. 元素E与元素B可形成具有正四面体结构的物质.请回答下列问题. (1)在周期表中.元素B位于 周期 族,A与C形成的离子化合物的电子式 为 ,A与C形成的离子化合物与水反应的化学方程式为 . (2)C.E形成的简单离子的离子半径大小关系为 . (3)D.E元素形成的化合物可与水反应生成一种沉淀和一种气体.试写出该反应的化学方程 式: . (4)单质B与水反应是将B充分利用的措施之一.试写出该反应的化学方程式: . 解析:由元素A的负一价离子具有和稀有气体He一样的结构推知A为H元素,由B元素的最外层电子数是内层电子总数的2倍推知B为C元素,由元素C是短周期元素中原子半径最大的主族元素.推断C为Na元素,由原子序数依次增大.得出D.E均为第三周期元素.又由于D在地壳中的含量位于第二位.推断D为Si元素,由元素E与元素B可形成具有正四面体结构的物质.推断E为Cl元素. 技巧点拨:掌握元素周期律的基本内容是进行元素推断的重要保证.本题在解题时要根据 题给信息并结合元素周期律的知识进行推断.“位.构.性 是推断的重要法宝.严格审 题是正确解决问题的途径.掌握短周期元素的特殊性是解题的突破口.如常温下的气态单 质有:H2.N2.O2.F2.Cl2,形成化合物种类最多的元素是C,最高价氧化物对应水化物 酸性最强的元素是Cl等. 答案:(1)第二 第ⅣA Na+[:H]- NaH+H2O===NaOH+H2↑ (2)r(Cl-)>r(Na+) (3)SiCl4+3H2O===H2SiO3↓+4HCl↑ (4)C+H2O(g) CO+H2
网址:http://m.1010jiajiao.com/timu3_id_81541[举报]
有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:C
(2)写出A、B、C形成的化合物M的电子式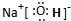
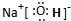 ;
;
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
(4)D单质与M的水溶液反应的离子方程式:
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C
钠
钠
,E氯
氯
;(2)写出A、B、C形成的化合物M的电子式
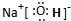
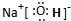
(3)实验测得DE3 在熔融状态下不导电,则DE3 中含有的化学键类型为
共价键
共价键
;(4)D单质与M的水溶液反应的离子方程式:
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.(2013?达州模拟)有A、B、C、D、E五种短周期元素,其中A元素和B元素的原子都有一个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价与最低化合价代数和为4;E元素的基态原子核外有六种运动状态的电子.请回答下列问题:
(1)A元素的简单离子基态时的电子排布式为

(2)CB3分子的空间构型是
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含
(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为
查看习题详情和答案>>
(1)A元素的简单离子基态时的电子排布式为
1s22s22p6
1s22s22p6
R是由C元素与氢元素两种元素形成的18电子分子,R的电子式为

(2)CB3分子的空间构型是
三角锥型
三角锥型
,其中心原子的杂化类型是sp3
sp3
(3)由D、E、C三元素可形成共价化合物(DEC)2(分子中各原子均达8电子稳定结构),每个分子中含
5
5
个δ键.(4)E的一种低价氧化物与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池.则该燃料电池的负极反应为
CO+CO32--2e-=2CO2
CO+CO32--2e-=2CO2
正极反应为O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
(5)1.2gE的单质在标准状况下的1.68L氧气中燃烧,至反应物耗尽,放出X KJ热量.则1molE与O2反应生成E的低价氧化物时的热化学方程式为
C(s)+
O2(g)=CO(g)△H=-(20X-Y)kJ/mol
| 1 |
| 2 |
C(s)+
O2(g)=CO(g)△H=-(20X-Y)kJ/mol
(已知:E的燃烧热为Y KJ/mol)| 1 |
| 2 |
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素最外层电子数是其次外层电子数的
倍,A、B、D、E这四种元素,每一种与C元素都形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)写出下列元素的元素符号:B
(2)用电子式表示D、E所形成的化合物:
 .
.
(3)E的最高价态与A、B、C三种元素形成的酸式盐Y的化学式是
(4)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,则这两种溶液中由水电离出来的H+浓度c1(H+):c2(H+)=
查看习题详情和答案>>
| 3 | 4 |
(1)写出下列元素的元素符号:B
N
N
,CO
O
.(2)用电子式表示D、E所形成的化合物:


(3)E的最高价态与A、B、C三种元素形成的酸式盐Y的化学式是
NH4HSO4
NH4HSO4
,该盐在水溶液中离子浓度由大到小的顺序是c(H+)>c(SO42-)>c(NH4+)>c(OH-)
c(H+)>c(SO42-)>c(NH4+)>c(OH-)
.(4)常温时,B元素的最高价氧化物对应水化物Z的溶液与盐X的溶液的pH均为a,则这两种溶液中由水电离出来的H+浓度c1(H+):c2(H+)=
102a-14
102a-14
. 有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:
有A、B、C、D、E五种短周期元素,其原子序数依次增大.A原子的电子层数与它的核外电子总数相同,B原子核外最外层电子数是次外层电子数的2倍,C元素的原子基态时2p能级是2s能级上的电子数的2倍,D是该周期中原子半径最大的主族元素,E原子的第一至第四电离能(kJ?mol-1)分别为:578、1817、2745、11575.请回答下列问题:(1)C、D两元素形成的化合物的晶体类型是
离子晶体
离子晶体
.BC2的结构式O=C=O
O=C=O
;(2)若F是D的同主族下一周期元素,则F的电子排布式是:
1S22S22P63S23P64S1
1S22S22P63S23P64S1
,(3)写出E的最高价氧化物对应的水化物与D的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.(4)A2C分子间因存在“氢键”的作用而彼此结合形成(A2C)n.在该分子形成的晶体中每个A2C分子被4个A2C分子包围形成变形的四面体,通过“氢键”相互连接成庞大的分子晶体,其结构示意图如图所示,试填空.
①含1molA2C的该晶体中有
2
2
mol“氢键”.②若G是C的同主族下一周期元素,请比较A2C与 A2G 沸点的高低
H2O>H2S
H2O>H2S
.现有A、B、C、D、E五种短周期元素,其中A、B两种元素同主族,A元素原子的最外层电子数是内层电子的数3倍;C是所有元素中原子半径最小的;D的气态氢化物水溶液能使湿润的红色石蕊试纸变蓝;在A、E形成的化合物EA中,A、E离子核外电子数均为10.请按要求回答下列问题:
Ⅰ.(1)写出元素E在元素周期表的位置
(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是
Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式
(2)在一定条件下,将a mol C单质和b mol D单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a 的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.
查看习题详情和答案>>
Ⅰ.(1)写出元素E在元素周期表的位置
第三周期第ⅡA族
第三周期第ⅡA族
;(2)在A、B、D分别形成的氢化物中,最稳定的氢化物是
H2O
H2O
(填化学式).Ⅱ.元素C、D形成的单质在一定条件下发生反应,生成化合物F,该反应是一种重要的化工反应.
(1)写出上述反应的化学方程式
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
;
| ||
| 高温高压 |
(2)在一定条件下,将a mol C单质和b mol D单质的混合气体通入20L的密闭容器中,发生上述反应.若反应进行到20min时,测得C单质和化合物F的物质的量分别为11mol和6mol.计算:
①a 的值
②用D单质表示该反应的化学反应速率.
(3)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中F的含量(体积分数)为25%,计算平衡时F的物质的量.