摘要:如图所示.将Cu(NO3)2·6H2O加热充分反应.关于A物质的说法正确的是 ( ) A.A物质有挥发性 B.A物质是硝酸铜溶液 C.物质的质量分数约为58.3% D.A物质的质量分数约为63.5% 解析:首先搞清楚发生的反应有①Cu(NO3)2·6H2OCu(NO3)2+6H2O,②2Cu(NO3)22CuO+4NO2↑+O2↑,③4NO2+O2+2H2O===4HNO3.显然A物质为硝酸溶液.假设起始有2 mol Cu(NO3)2·6H2O.所得硝酸溶液的质量分数为×100%=58.3%.显然AC正确. 答案:AC
网址:http://m.1010jiajiao.com/timu3_id_81513[举报]
钛(Ti)被称为继铁、铝之后的“21世纪金属”金属,应用前景广泛.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.

(1)电解食盐水总反应的离子方程式是 ;
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式 ;
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol;
②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ/mol.
下列说法正确的是 ;
A.Mg的燃烧热为641kJ/mol
B.Ti的能量一定比TiCl4高
C.该冶炼Ti法对环境友好
D.等质量的Mg(s)、Ti(s)足量的氯气反应,前者放出的热量多
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极的电极反应式 .
(5)若日产甲醇(CH3OH)8t,理论上需多少t氢气 (不考虑生产过程中的损失). .
查看习题详情和答案>>

(1)电解食盐水总反应的离子方程式是
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式
(3)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ/mol;
②Ti(s)+2Cl2(g)=TiCl4(s)△H=-770kJ/mol.
下列说法正确的是
A.Mg的燃烧热为641kJ/mol
B.Ti的能量一定比TiCl4高
C.该冶炼Ti法对环境友好
D.等质量的Mg(s)、Ti(s)足量的氯气反应,前者放出的热量多
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中正极的电极反应式
(5)若日产甲醇(CH3OH)8t,理论上需多少t氢气 (不考虑生产过程中的损失).
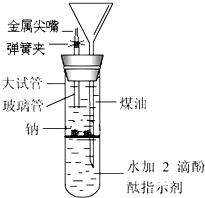 有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反应速率.使学生能仔细观察到各种实验现象.该方法简便、安全、现象明显、有趣味性.实验装置如图所示,将规格为6×55mm玻璃管和长颈漏斗插入橡皮孔中,玻璃管外套上30mm的乳胶管,乳胶管上再接规格为6×30mm金属尖嘴管,乳胶管上夹上弹簧夹.
有人设计出一种在隔绝空气下让钠与水反应的方法,利用煤油来控制反应速率.使学生能仔细观察到各种实验现象.该方法简便、安全、现象明显、有趣味性.实验装置如图所示,将规格为6×55mm玻璃管和长颈漏斗插入橡皮孔中,玻璃管外套上30mm的乳胶管,乳胶管上再接规格为6×30mm金属尖嘴管,乳胶管上夹上弹簧夹.实验时,往100mL的大试管中先加入40mL煤油,取2粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过漏斗加满滴有酚酞的水.根据反应中观察到的现象,回答下列问题.
根据反应中观察到的现象,回答下列问题:
(1)金属钠变化的现象是
钠在煤油中逐渐下沉,至水面时与水发生反应,熔化成银白色小球,生成的氢气推动钠上浮至煤油层,当氢气溢出,钠又回落至界面与水反应,如此反复多次,最后完全消失(或钠在么煤油中做上下跳动,最后完全消失)
钠在煤油中逐渐下沉,至水面时与水发生反应,熔化成银白色小球,生成的氢气推动钠上浮至煤油层,当氢气溢出,钠又回落至界面与水反应,如此反复多次,最后完全消失(或钠在么煤油中做上下跳动,最后完全消失)
.(2)大试管中溶液颜色的变化是
水溶液从上至下逐渐由无色变为红色
水溶液从上至下逐渐由无色变为红色
.(3)装置中液面的变化分别是:大试管中
液面逐渐下降;
液面逐渐下降;
;长颈漏斗中液面逐渐上升
液面逐渐上升
.(4)简述检验产生的气体的方法:
当漏斗中逐渐上升到一定高度后,打开弹簧夹点燃气体,有淡蓝色火焰产生
当漏斗中逐渐上升到一定高度后,打开弹簧夹点燃气体,有淡蓝色火焰产生
.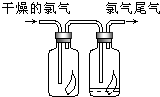 舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.
舍勒发现氯气的方法至今还是实验室制取氯气的主要方法之一.(1)请写出实验室制氯气的反应化学方程
(2)反应方程式中氧化剂和还原剂物质的量之比为
(3)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(4)实验室中剩余的Cl2尾气通常用NaOH溶液吸收,发生反应的离子方程式
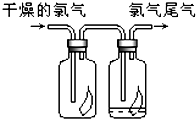 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现是潮湿的有色布条褪色而干燥的有色布条不褪色
潮湿的有色布条褪色而干燥的有色布条不褪色
.(2)写出氯气与水反应的方程式式
H2O+Cl2═HClO+HCl
H2O+Cl2═HClO+HCl
.该反应中氧化剂与还原剂物质的量之比是1:1
1:1
.(3)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用氢氧化钠溶液吸收多余的氯气,原理是(用化学方程式表 示)
2NaOH+Cl2═NaClO+NaCl+H2O
2NaOH+Cl2═NaClO+NaCl+H2O
.根据这一原理,工业上常用廉价的石灰乳]吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式).(4)氯气一旦泄漏,后果是非常严重的.当人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是
D
D
.A.NaOH B.NaCl C. KBr D. Na2CO3.
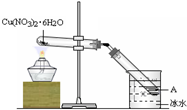 (2009?松江区二模)如图所示,将Cu(NO3)2?6H2O加热充分反应,关于A物质的说法正确的是( )
(2009?松江区二模)如图所示,将Cu(NO3)2?6H2O加热充分反应,关于A物质的说法正确的是( )