网址:http://m.1010jiajiao.com/timu3_id_81073[举报]
下图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、F、H都含有同一种元素;B、D、E为单质,其他为化合物,常温常压下C为无色液体,D、E为气体;H的晶体熔点高、硬度大、闪烁着晶莹的光泽。A~H之间的转化关系如图所示。 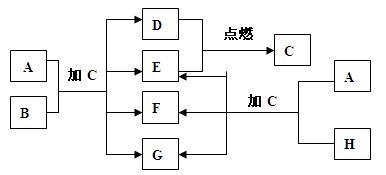
(1)C的化学式为 、A的电子式为 ;
(2)A、B的混合物加C后,可能发生的反应的化学方程式为 、 ;
(3)向F溶液中逐渐滴入盐酸直至过量,若看到的现象是先出现白色沉淀后沉淀消失,写出符合现象的离子方程式 ,与之对应的D、E恰好完全反应生成C时A与B的物质的量之比为: ;
下图中的A~H是中学化学中常见的八种物质,所有物质均由短周期元素组成,其中B、F、H都含有同一种元素;B、D、E为单质,其他为化合物,常温常压下C为无色液体,D、E为气体;H的晶体熔点高、硬度大、闪烁着晶莹的光泽。A~H之间的转化关系如图所示。
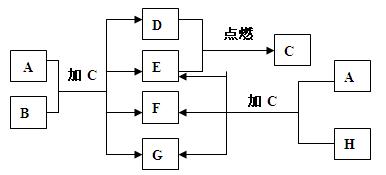
(1)C的化学式为 、A的电子式为 ;
(2)A、B的混合物加C后,可能发生的反应的化学方程式为 、 ;
(3)向F溶液中逐渐滴入盐酸直至过量,若看到的现象是先出现白色沉淀后沉淀消失,写出符合现象的离子方程式 ,与之对应的D、E恰好完全反应生成C时A与B的物质的量之比为: ;
查看习题详情和答案>>
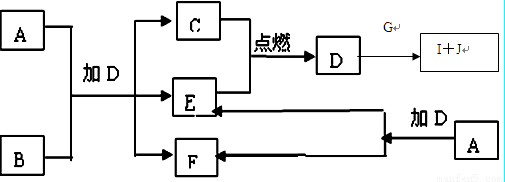
(2)向A、D物质的水溶液中分别滴入酚酞试液后,溶液均显红色,说明溶液均显________(填“酸”或 “碱”)性,其原理是否相同?____(填“相同” 或“不相同”),请用必要的文字加以解释并写出离 子方程式:_____________________
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方 程式:________________。

 。
。 程式
程式  。
。