摘要:11.我国具有广泛的海域.大部分海域中存在蛭石.蛭石为一种层状结构的含镁的水铝硅酸盐.是黑云母等天然矿物风化蚀变的产物.因为其受热膨胀时呈挠曲状.形态酷似水蛭.故此得名蛭石.膨化后的蛭石呈颗粒状.有隔热.耐冻.抗菌.防火.吸声等优异性能.但不耐酸. (1)某硅酸盐矿石的组成可以看成是二氧化硅中1/3的硅被铝置换.再由钾平衡其电荷形成的.该矿石的组成以氧化物的形式表示为 . (2)某校研究性学习小组取某牌的膨化蛭石样品.其成分可以用氧化物(MgO.Fe2O3.Al2O3.SiO2.H2O)的形式表示.为研究蛭石的组成.拟进行实验探究.实验流程及相关数据如下: ①固体A的化学式是 . ②固体F的物质的量是 . ③写出滤液C与足量二氧化碳反应的离子方程式: . ④通过计算.写出用氧化物的形式表示该膨化蛭石组成的化学式: . ⑤过滤.灼烧都需使用的仪器是 . ⑥有同学认为.该实验流程中第一步的盐酸可以用氢氧化钠溶液代替.你的观点是 .理由是 . 解析:(1)因二氧化硅中有1/3的硅原子被铝原子取代.不足的由钾原子补充.使化合价代数和为0.故一个硅原子可被一个铝原子和一个钾原子取代.则3SiO2―→Si2AlKO6―→Si4Al2K2O12―→K2O·Al2O3·4SiO2―→较活泼金属氧化物·较不活泼金属氧化物·非金属根据实验流程图知.固体A为二氧化硅.n(SiO2)=2.40 g/60 g·mol-1=0.04 mol.D为氢氧化铁和氢氧化镁.G为氧化铁和氧化镁.设氧化铁和氧化镁的物质的量分别为x.y.则160 g·mol-1×x+40 g·mol-1×y=4.80 g ①.107 g·mol-1×2x+58 g·mol-1×y=6.78 g ②.联立①②解得:x=0.01 mol.y=0.08 mol.即n(Fe2O3)=0.01 mol.n(MgO)=0.08 mol.固体F为Al(OH)3.n[Al(OH)3]=1.56 g/78 g·mol-1=0.02 mol.n(Al2O3)=0.01 mol.故n(H2O)=(8.58 g-40 g·mol-1×0.08 mol-2.40 g-160 g·mol-1×0.01 mol-102 g·mol-1×0.01 mol)/18 g·mol-1=0.02 mol.则n(MgO)∶n(Fe2O3)∶n(Al2O3)∶n(SiO2)∶n(H2O)=0.08 mol∶0.01 mol∶0.01 mol∶0.04 mol∶0.02 mol=8∶1∶1∶4∶2.即该膨化蛭石的组成为8 MgO·Al2O3·Fe2O3·4SiO2·2H2O. 答案:(1)K2O·Al2O3·4SiO2 (2)①SiO2 ②0.020 mol ③CO2+OH-===HCO3-,AlO2-+CO2+2H2O===Al(OH)3↓+HCO3- ④8MgO·Al2O3·Fe2O3·4SiO2·2H2O ⑤玻璃棒 ⑥不能改用氢氧化钠溶液 二氧化硅.氧化铝均能溶于氢氧化钠溶液
网址:http://m.1010jiajiao.com/timu3_id_81023[举报]
能源短缺是人类面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应I,5分钟后测得c(CO)=0.2mol/L,计算此段时间的反应速率(用H2表达) mol/(L?min).
(2)由表中数据判断Q1 0(填“>”、“<”或“=”).
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是 (选填编号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K= ;由于CO2化学惰性很大,因此找到合适的催化剂是实现该反应工业化的关键.该反应使用催化剂无法达到的效果是 (选填编号).
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
查看习题详情和答案>>
反应I:CO(g)+2H2(g)?CH3OH(g)+Q1
反应Ⅱ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+Q2
下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
(2)由表中数据判断Q1
(3)若容器容积不变,下列措施可提高反应I中CO转化率的是
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.原料气循环使用
(4)写出反应Ⅱ的平衡常数表达式:K=
a.提高甲醇的单位时间产量 b.提高CO2的转化率 c.缩短达到平衡所需时间.
 (2013?德州模拟)钠及其化合物具有广泛的用途.
(2013?德州模拟)钠及其化合物具有广泛的用途.(1)工业上可利用反应Na(l)+KCl(l)?K(g)+NaCl(l)来治炼金属钾,此反应利用了钠的还原性及
金属钠的沸点高于金属钾的沸点
金属钠的沸点高于金属钾的沸点
,写出钠与TiCl4反应冶炼Ti的化学方程式4Na+TiCl4
Ti+4NaCl
| ||
4Na+TiCl4
Ti+4NaCl
.
| ||
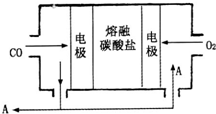
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如右:负极电极反应式为
2CO-4e-+2CO32-=4CO2
2CO-4e-+2CO32-=4CO2
,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为CO2
CO2
.(3)常温下,浓度均为0.1mol?L-1的下列五种钠盐溶液的pH如下表;
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
CO32-
CO32-
,根据表中数据,浓度均为0.01mol?L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是C
C
(填编号).A.HCN B.HClO C.CH3COOH D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300mL 1mol?L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)
.(5)几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
Cu2+
Cu2+
(填离子符号)先沉淀,KSP[(Fe(OH)2]<
<
KSP[(Mg(OH)2](填“>”、“=”或“<”).能源短缺是人类社会面临的最大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下面有关甲醇参与反应的有关问题
(1)火力发电厂释放出的氮氧化物(NOx)、二氧化硫和二氧化碳等气体进行脱硝、脱硫和脱碳等处理.可实现绿色环保、节能减排、废物利用等目的.其中,脱碳时将CO2转化为甲醉的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的傲之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图甲所示,则上述CO2转化为甲醇的反应中△H 0(填“>“、“<“或“=“)
②在一恒温恒容(容积为2L)密闭容器中充入2mol CO2和6mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图乙所示.试计算:0-10min内,氢气的平均反应速率v(H2)= ;该温度下,反应的平衡常数K=
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)→2C2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
写出表示甲醉燃烧热的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图丙所示的电池装置.
①该电池的正极反应式为 ;负极反应式为
②工作一段时间后,当消耗3.2g甲醇时,同时消耗掉的KOH是 g.

查看习题详情和答案>>
(1)火力发电厂释放出的氮氧化物(NOx)、二氧化硫和二氧化碳等气体进行脱硝、脱硫和脱碳等处理.可实现绿色环保、节能减排、废物利用等目的.其中,脱碳时将CO2转化为甲醉的热化学方程式为:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的傲之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如下图甲所示,则上述CO2转化为甲醇的反应中△H
②在一恒温恒容(容积为2L)密闭容器中充入2mol CO2和6mol H2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如下图乙所示.试计算:0-10min内,氢气的平均反应速率v(H2)=
(2)已知在常温常压下:①2CH3OH(l)+3O2(g)→2C2(g)+4H2O(g)△H=-1275.6kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
写出表示甲醉燃烧热的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,设计如下图丙所示的电池装置.
①该电池的正极反应式为
②工作一段时间后,当消耗3.2g甲醇时,同时消耗掉的KOH是

(2013?闵行区一模)氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
查看习题详情和答案>>
(1)下列生产、生活中的事例中没有发生氧化还原反应的是
c
c
(选填编号).a.煤的形成 b.原电池工作
c.简单机械织布 d.我国古代烧制陶器
(2)水是人体的重要组成部分,是人体中含量最多的一种物质.“四种基本反应类型与氧化还原反应的关系”可用下图表示.

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
| ||
2F2+2H2O=4HF+O2或2Na+2H2O=2NaOH+H2↑或C+H2O
CO+H2
.
| ||
(3)工业上利用NaIO3和NaHSO3反应来制取单质I2.配平下列化学方程式并标明电子转移的方向和数目:
4
4
NaIO3+10
10
NaHSO3→2
2
I2+7
7
Na2SO4+3
3
H2SO4+2
2
H2O(4)已知:还原性HSO3->I-,若加入的NaHSO3过量,还可能与上述生成物中的
I2
I2
反应,离子方程式为H2O+I2+HSO3-=2I-+SO42-+3H+
H2O+I2+HSO3-=2I-+SO42-+3H+
.(10分)钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
|
pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为__________ ______ 。
②几种离子开始沉淀时的pH如下表:
|
离子 |
Fe2+ |
Cu2+ |
Mg2+ |
|
pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,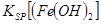 _________
_________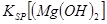 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
查看习题详情和答案>>