摘要:13.某实验小组利用如右装置制备氮化钙(Ca3N2).并探究其实验式. (1)按图连接好实验装置.检查装置的气密性.方法是 . (2)反应过程中末端导管必须始终插入试管A的水中.目的是 . (3)制备氮化钙的操作步骤是:①打开活塞K并通入N2,②点燃酒精灯.进行反应,③反应结束后. ,④拆除装置.取出产物. (4)数据记录如下: 空瓷舟质量m0/g 瓷舟与钙的质量m1/g 瓷舟与产物的质量m2/g 14.80 15.08 15.15 ①计算得到实验式CaxN2.其中x= . ②若通入的N2中混有少量O2.请比较x与3的大小.并给出判断依据: . 解析:本题考查实验操作.实验计算及误差分析.(3)Ca3N2能与水反应.所以反应完成后.通N2以防Ca3N2与水反应.影响测定结果. (4)①m(Ca)=15.08 g-14.80 g=0.28 g m(N2)=15.15 g-15.08 g=0.07 g ==2.8 即x=2.8. 答案:(1)关闭活塞K.微热反应管.试管A中有气泡冒出.停止加热.冷却后若末端导管中水柱上升且高度保持不变.则说明装置气密性良好 (2)防止反应过程中空气进入反应管,便于观察N2流速 (3)熄灭酒精灯.待反应管冷却至室温.停止通N2.并关闭活塞K (4)①2.80 ②x<3因为O2和N2分别与等量的Ca反应.生成CaO的质量高于Ca3N2.若通入的N2中混有少量O2.会导致计算出的n(N)偏大.所以n(Ca)/n(N)<3/2.即x<3
网址:http://m.1010jiajiao.com/timu3_id_80876[举报]
某课外小组利用如右图装置进行相关实验,请回答下列
问题。
(1)仪器D在实验中的作用是 ,
实验开始之前应进行的第一项操作是 ;
(2)若将A容器中的液体逐滴加人到B容器的固体中,
产生气体,该气体可以是(填化学式,写出2种即
可) ;
(3)若 A中装有浓盐酸,B中装有高锰酸钾固体,C容器中装有淀粉碘化钾溶液,旋开E后,一段时间C中溶液变蓝色,写出B中发生反应的化学方程式 ;当有1.6 mol浓盐酸被氧化时,生成的氯气的体积为____________mL(STP)。
(4)工业上用电解饱和 氯化钠溶液的方法制取氯气,写出该反应的离子方程式 。
氯化钠溶液的方法制取氯气,写出该反应的离子方程式 。
查看习题详情和答案>>
 某课外小组利用如图装置进行相关实验,请回答下列问题.
某课外小组利用如图装置进行相关实验,请回答下列问题.(1)仪器D在实验中的作用是
(2)若将A容器中的液体逐滴加人到B容器的固体中,产生气体,该气体可以是(填化学式,写出2种即可)
(3)若 A中装有浓盐酸,B中装有高锰酸钾固体,C容器中装有淀粉碘化钾溶液,旋开E后,一段时间C中溶液变蓝色,写出B中发生反应的化学方程式
(4)工业上用电解饱和氯化钠溶液的方法制取氯气,写出该反应的离子方程式
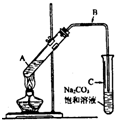 (2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究.
(2009?成都一模)某兴趣小组利用如图装置,取不同浓度的硫酸与 3mL 无水乙醇和 2mL 冰醋酸分别进行制取乙酸乙酯的研究.(1)A 试管内生成乙酸乙酯的化学反应方程式为:
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2OCH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
; CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(2)导气管 B 的管口没有插入饱和碳酸钠液面以下,原因是
防止碳酸钠液体倒吸,便于乙酸乙酯流出
防止碳酸钠液体倒吸,便于乙酸乙酯流出
;(3)兴趣小组记录的实验现象和结果如表:
| 组序号 | 催化剂 | 反应现象 | C中饱和碳酸钠溶液中酯层高度 |
| ① | 2mL98%浓硫酸 | 20秒时溶液出现棕色,随反应进行,溶液颜色逐渐加深,最后成黑色;酯层无气泡. | 2.10cm |
| ② | 2mL14mol?L-1硫酸 | 反应后溶液颜色呈棕色,酯层与饱和碳酸钠溶液界面清晰,无气泡. | 2.14cm |
| ③ | 2mL10mol?L-1硫酸 | 反应后溶液颜色呈无色,酯层与饱和碳酸钠溶液界面清晰,无气泡. | 2.16cm |
| ④ | 2mL7mol?L-1硫酸 | 反应后溶液颜色呈无色,酯层与饱和碳酸钠溶液有气泡. | 2.00cm |
98%的浓硫酸具有强氧化性,使部分反应物炭化
98%的浓硫酸具有强氧化性,使部分反应物炭化
;若同时有刺激性气味的气体产生,则可能发生的化学反应方程式是:CH3CH2OH+2H2SO4(浓)
2C↓+2SO2↑+5H2↑
| △ |
CH3CH2OH+2H2SO4(浓)
2C↓+2SO2↑+5H2↑
.| △ |
Ⅱ.试管 C 的酯层中没有乙酸的实验组是(填组序号
①②③
①②③
;从实验结果分析,选用催化剂的最佳浓度是10 mol?L-1
10 mol?L-1
.(4)写出C4H8O2的所有酯类的同分异构体的结构简式
HCOOCH2CH2CH3;HCOOCH(CH3)2,CH3COOCH2CH3,CH3CH2COOCH3
HCOOCH2CH2CH3;HCOOCH(CH3)2,CH3COOCH2CH3,CH3CH2COOCH3
.
某兴趣小组利用如下图装置探究Cl2的性质.
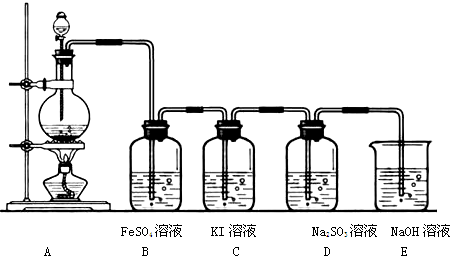
回答下列问题:
(1)A装置制取氯气时,在烧瓶里加入一定量的漂白粉,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在A与B之间安装盛有 (填写下列编号字母)的净化装置.
A、碱石灰 B、饱和食盐水 C、浓硫酸 D、饱和碳酸氢钠溶液
(2)B溶液发生反应的离子方程式
(3)D中SO32-被Cl2氧化生成的微粒是
(A)SO42- B、S C、SO2 D、H2SO4
(4)C中现象是无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
① ;②I2+Cl2+H2O═HIO3+ (不必配平).
(5)E中NaOH的作用是 .为证明E溶液中存在ClO-,取少量E中溶液放入试管中,滴加稀H2SO4至溶液呈酸性,再加入淀粉KI溶液,预期现象和结论是 .
查看习题详情和答案>>

回答下列问题:
(1)A装置制取氯气时,在烧瓶里加入一定量的漂白粉,通过
A、碱石灰 B、饱和食盐水 C、浓硫酸 D、饱和碳酸氢钠溶液
(2)B溶液发生反应的离子方程式
(3)D中SO32-被Cl2氧化生成的微粒是
(A)SO42- B、S C、SO2 D、H2SO4
(4)C中现象是无色溶液变成棕黄色后又褪色.这是因为发生如下2个反应:
①
(5)E中NaOH的作用是
(2012?浦东新区二模)乙醚极易挥发、微溶于水、是良好的有机溶剂.乙醇与浓硫酸的混合物在不同温度下反应能生成乙烯或乙醚.某实验小组用如图装置制取乙醚和乙烯.

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择
(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
(2)Ⅲ中水冷凝管的进水口是
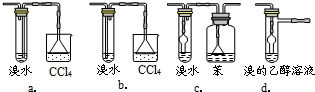
(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)
(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是
②蒸馏操作可除去的杂质是
(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)
a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液.
查看习题详情和答案>>
| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |

(1)制乙醚:在蒸馏烧瓶中先加入10mL乙醇,慢慢加入10mL浓硫酸,冷却,固定装置.加热到140℃时,打开分液漏斗活塞,继续滴加10mL乙醇,并保持140℃,此时烧瓶c中收集到无色液体.
(1)Ⅰ和Ⅱ是反应发生装置,应该选择
Ⅰ
Ⅰ
(选答“Ⅰ”或“Ⅱ”)与装置Ⅲ相连.(2)乙醇通过分液漏斗下端连接的长导管插入到液面下加入,目的有二,一是使反应物充分混合,二是
防止乙醇挥发
防止乙醇挥发
.(2)Ⅲ中水冷凝管的进水口是
b
b
(选答“a”或“b”).冰盐水的作用是冷凝液化乙醚
冷凝液化乙醚
.(3)有同学认为以上装置还不够完善,一是溴水可能倒吸,二是尾气弥漫在空气中遇明火危险.该同学设计了以下几种装置与导管d连接,你认为合理的是(选填编号)
c、d
c、d
.
(4)反应一段时间后,升温到170℃,观察到反应物变为黑色,溴水褪色.写出实验过程中所有生成气体的反应方程式
CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O
| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
CH3CH2OH+6H2SO4
2CO2↑+6SO2↑+9H2O;C+2H2SO4
CO2↑+2SO2↑+2H2O;CH3CH2OH
C2H4↑+H2O;CH3CH2OH+2H2SO4
2C+2SO2↑+5H2O
.| △ |
| △ |
| 浓硫酸 |
| 170℃ |
| △ |
(5)实验中收集到的乙醚产品中可能含有多种杂质.某同学设计了以下提纯方案:

①分液步骤除去产品中的酸性杂质,则X可以是
NaOH
NaOH
.②蒸馏操作可除去的杂质是
乙醇(CH3CH2OH)
乙醇(CH3CH2OH)
.(6)工业乙醚常因接触空气和光而被氧化,含有少量过氧化物,除去过氧化物的试剂及操作分别是(选填编号)
b、d
b、d
.a.CCl4、萃取 b.Na2SO3溶液、分液
c.Na2SO4溶液、过滤 d.酸化的FeSO4溶液、分液.