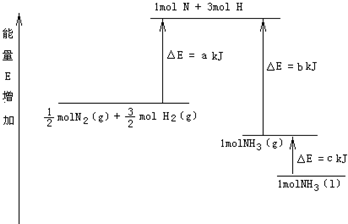
摘要:13.化学反应N2+3H22NH3的能量变化如图所示.该反应的热化学方程式是( ) A.N2(g)+3H2(g)2NH3(l), ΔH=2(a-b-c) kJ·mol-1 B.N2(g)+3H2(g)2NH3(g), ΔH=2(b-a) kJ·mol-1 C. N2(g)+H2(g)NH3(l),ΔH=(b+c-a) kJ·mol-1 D. N2(g)+H2(g)NH3(g),ΔH=(a+b) kJ·mol-1 解析:通过图分析起点 mol N2(g)+ mol H2(g).变化三阶段为①吸收能量a kJ,②放出能量b kJ,③放出能量c kJ到1 mol NH3(l).故可得热化学方程式: N2(g)+H2(g)NH3(l) ΔH=(a-b-c) kJ·mol-1.扩大计量数后得到A. 答案:A
网址:http://m.1010jiajiao.com/timu3_id_80859[举报]
已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是
(2)
N2(g)+
H2(g)=NH3(g);△H=
(3)N2(g)和H2生成NH3(1)的热化学方程式为

查看习题详情和答案>>
(1)1mol N 和3mol H 生成1mol NH3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).(2)
| 1 |
| 2 |
| 3 |
| 2 |
(a-b)kJ/mol
(a-b)kJ/mol
;(3)N2(g)和H2生成NH3(1)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.
化学反应N2+3H2?2NH3的能量变化如图所示,该反应的热化学方程式是( )
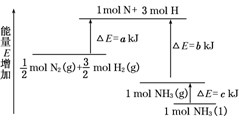

| A、N2(g)+3H2(g)?2NH3(l);△H=2(a-b-c) kJ/mol | ||||
| B、N2(g)+3H2(g)?2NH3(g);△H=2(b-a) kJ/mol | ||||
C、
| ||||
D、
|
 (2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
(2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )