网址:http://m.1010jiajiao.com/timu3_id_79995[举报]
(1)除去(NH4)2CO3用加热好还是加强碱后再进行加热好?
你选择的是
(2)除去S
| O | 2- 4 |
| O | 2- 4 |
(2)实验室需要纯净的NaCl溶液,但现有的NaCl晶体混有少量Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微
热好?你选择的是________。其理由是判断(NH4)2CO3已除尽的方法是________。
②除去SO42-的方法是________。
判断SO42-已除尽的方法是
查看习题详情和答案>>
(1)为了得到高级工业用的和食用的盐(NaCl),必须将盐卤中的Mg2+、Ca2+、重金属离子、SO42-等可溶性杂质进行沉淀分离。现有下列药品可供选用:H2SO4、HCl、HNO3、Na2CO3、石灰乳、BaCO3、BaCl2、NH3H2O、K2CO3。则所选用的试剂由先到后的顺序是________。
(2)实验室需要纯净的NaCl溶液,但现有的NaCl晶体混有少量Na2SO4和(NH4)2CO3,请设计实验除去杂质,并回答下列问题:
①除去(NH4)2CO3用加热好还是加强碱后再微
热好?你选择的是________。其理由是判断(NH4)2CO3已除尽的方法是________。
②除去SO42-的方法是________。
判断SO42-已除尽的方法是
查看习题详情和答案>>
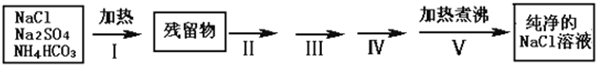
(1)步骤 I除去的杂质是(填化学式)
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
| 操作步骤 | 实验现象 | 实验目的 |
| 步骤II:将残留物溶解得到溶液, |
||
| 步骤III: |
||
| 步骤IV:过滤,往滤液中 |
||
| 步骤V:将溶液加热煮沸 |
实验室需要纯净的NaCl溶液,但实验室的NaCl晶体混有少量Na2SO4和NH4HCO3,某同学按如下流程图设计实验除去杂质,回答下列问题:

(1)步骤I除去的杂质是(填化学式)_______________,直接加热要好于加强碱后再进行加热,理由是 ;
(2)按流程图完成实验设计,将相关的实验操作、实验现象和实验目的填写在下表中:
|
操作步骤 |
实验现象 |
实验目的 |
|
步骤II:将残留物溶解得到溶液, |
|
|
|
步骤III:
|
|
|
|
步骤IV:过滤,往滤液中
|
|
|
|
步骤V:将溶液加热煮沸 |
|
|
(3)若最后得到20℃的NaCl饱和溶液。已知20℃时NaCl的溶解度为36.0g、NaCl饱和溶液的密度为1.12g/cm3 ,则20℃的NaCl饱和溶液的物质的量浓度为 mol/L(计算结果保留三位有效数字)。
查看习题详情和答案>>

