摘要:[知识与方法]1.D 2.B 3.B 4.D 5.A 6.C 7.C 8.A
网址:http://m.1010jiajiao.com/timu3_id_79738[举报]
随着环保意识的增强,清洁能源越来越受人们关注,
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:
A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4
MnFe2O4-x+
↑则框内的物质为:
查看习题详情和答案>>
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:
275.4KJ
275.4KJ
;(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:
A
A
(填序号)A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1
>
>
K2;(填“>”,“<”或“=”)(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4
| ||
| x |
| 2 |
O2
O2
;第二步反应方程式为:MnFe2O4-x+xH2O=MnFe2O4+xH2
MnFe2O4-x+xH2O=MnFe2O4+xH2
.随着环保意识的增强,清洁能源越来越受人们关注。
(1)甲烷是一种洁净能源,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/mol
H2O(l)=H2O(g) △H=+44 kJ/mol
则4.8 g甲烷气体燃烧生成液态水放出的热量为_________________
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH4(g) +H2O(g)=CO(g) +3H2(g) △H=+206.1 kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0 mol/L;c(H2O)=8.5 mol/L;c(CO)=2.0 mol/L;c(H2) =2.0 mol/L,则此时正逆反应速率的关系是___(填序号)。
A.v正>v逆 B.v正<v逆 C.v正=v逆 D.无法判断
②若将温度降至600℃,此时平衡常数为K2,则K1 ___K2(填“>”、“<”或“=”)。
(3)利用MnFe2O4作催化剂,通过两步反应可将水分解制得H2,第一步反应为:
MnFe2O4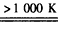 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______
则框内物质为:_____________,第二步反应方程式为:________________________
查看习题详情和答案>>
(1)甲烷是一种洁净能源,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/mol
H2O(l)=H2O(g) △H=+44 kJ/mol
则4.8 g甲烷气体燃烧生成液态水放出的热量为_________________
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:
CH4(g) +H2O(g)=CO(g) +3H2(g) △H=+206.1 kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0 mol/L;c(H2O)=8.5 mol/L;c(CO)=2.0 mol/L;c(H2) =2.0 mol/L,则此时正逆反应速率的关系是___(填序号)。
A.v正>v逆 B.v正<v逆 C.v正=v逆 D.无法判断
②若将温度降至600℃,此时平衡常数为K2,则K1 ___K2(填“>”、“<”或“=”)。
(3)利用MnFe2O4作催化剂,通过两步反应可将水分解制得H2,第一步反应为:
MnFe2O4
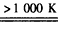 MnFe2O4-x+x/2_______
MnFe2O4-x+x/2_______则框内物质为:_____________,第二步反应方程式为:________________________
随着环保意识的增强,清洁能源越来越受人们关注。
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H= -802.3kJ/mol H2O(l)=H2O(g);△H= +44 kJ/mol,则4.8 g甲烷气体燃烧生成液态水放出热量为:_____________;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:
CH4(g) +H2O(g)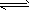 CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4) =3. 0mol/L,c(H2O)=8.5 mol/L,c(CO)= 2.0 mol/L,c(H2) =2.0 mol/L,则此时正逆反应的速率 关系是:__________(填序号)。
A. v正>v逆 B. v正<v逆 C.v正=v逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则 K1____(填“>”“<”或“=”)K2;
(3)利用MnFe2O4作催化剂,通过两步反应可将水分解制得H2,第一步反应为:
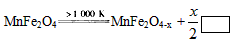 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为:
______________________。
查看习题详情和答案>>
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H= -802.3kJ/mol H2O(l)=H2O(g);△H= +44 kJ/mol,则4.8 g甲烷气体燃烧生成液态水放出热量为:_____________;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:
CH4(g) +H2O(g)
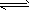 CO(g)+3H2(g);△H= +206.1 kJ/mol
CO(g)+3H2(g);△H= +206.1 kJ/mol ①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4) =3. 0mol/L,c(H2O)=8.5 mol/L,c(CO)= 2.0 mol/L,c(H2) =2.0 mol/L,则此时正逆反应的速率 关系是:__________(填序号)。
A. v正>v逆 B. v正<v逆 C.v正=v逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则 K1____(填“>”“<”或“=”)K2;
(3)利用MnFe2O4作催化剂,通过两步反应可将水分解制得H2,第一步反应为:
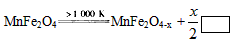 则框内的物质为:________; 第二步反应方程式为:
则框内的物质为:________; 第二步反应方程式为:______________________。
随着环保意识的增强,清洁能源越来越受人们关注,
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:______;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:______(填序号)
A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1______K2;(填“>”,“<”或“=”)
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4 MnFe2O4-x+
MnFe2O4-x+ ↑则框内的物质为:______;第二步反应方程式为:______.
↑则框内的物质为:______;第二步反应方程式为:______.
查看习题详情和答案>>
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:______;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:______(填序号)
A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1______K2;(填“>”,“<”或“=”)
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4
 MnFe2O4-x+
MnFe2O4-x+ ↑则框内的物质为:______;第二步反应方程式为:______.
↑则框内的物质为:______;第二步反应方程式为:______.查看习题详情和答案>>
| |||||||||||||||||||||||||||||