网址:http://m.1010jiajiao.com/timu3_id_79645[举报]
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)=c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、![]() c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+c(CO32—)+ c(H2CO3)
C、c(Na+)>c(CO32—)> c(HCO3—)> c(OH—)>c(H+)
D、c(Na+)>c(HCO3—)> c(CO32—)> c(OH—)>c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2OH++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>
(8分)现有以下四种溶液;①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液.请回答下列问题:
(1) ②④溶液中由水电离出来的c(H+)的关系是:② ④(填“>”“<”或“=”).
(2) 将②③溶液等体积混合后,溶液的pH 7 (填“>”“<”或“:”). ,
(3)将①④溶液均稀释至原来的10倍后,它们的pH之和 14(填“>”“<”或“=”).
(4)向300 mL溶液④中通入44.8 mL C02(标准状况)气体,充分反应后,溶液中粒子浓度关系正确的是 ( )
A、c(Na+)+ c(H+)= c(OH—)+ c(HCO3—)+ 2c(CO32—)
B、 c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+
c(CO32—)+ c(H2CO3)
C、c(Na+)> c(CO32—)> c(HCO3—)> c(OH—)> c(H+)
D、c(Na+)> c(HCO3—)> c(CO32—)> c(OH—)> c(H+)
【解析】(1)水属于弱电解质,存在电离平衡:H2O H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
H++OH—。所以不论是酸还是碱均是抑制水的电离,②和④中氢离子和OH—的的浓度均相同,抑制水的电离程度是相同的,所以由水电离出来的c(H+)是相同的。
(2)盐酸的浓度是0.01mol/L,氨水是弱电解质,所以其浓度大于0.01mol/L,因此反应后氨水是过量的,溶液显碱性,pH大于7.
(3)。强碱每稀释10n倍,强碱的pH就减小n个单位,所以pH=12的氢氧化钠稀释10倍,pH=11。但醋酸是弱电解质,稀释10倍后溶液的pH将大于3,所以它们的pH之和小于14.
(4)300mlpH=12的氢氧化钠,其物质的量是0.01mol/L×0.3L=0.003mol。44.8 mL C02(标准状况)气体的物质的量是0.002mol,所以二者混合反应后生成物是碳酸钠和碳酸氢钠的混合液,其中二者的物质的量均是0.001mol。CO32-的水解程度大于HCO3-的水解程度,所以选项C错误,D正确。选项A符合电荷守恒,选项B符合物料守恒,均正确。
查看习题详情和答案>>
(1)工业上由NaCl制Na的化学方程式为
| ||
| 熔融 |
| ||
| 熔融 |
(2)如图为电解食盐水与乙烯和Cl2加成制l,2-=氯乙烷的联合装置示意图:
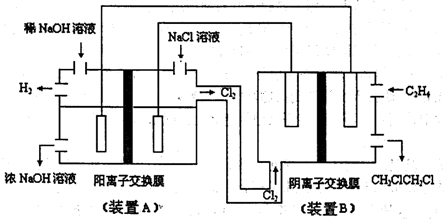
在该装置中,
(3)常温下,NaHCO3溶液中存在的质子守恒关系式为:c(OH-)+
加热0.5mol?L-1NaHCO3溶液,使NaHCO380%分解,然后恢复至室温.假设反应前后溶液的体积不变,则反应后的溶液中c(CO2-3)+c(HCO3+c(H2CO3)=
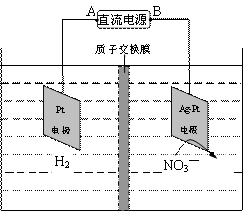
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1) 催化反硝化法中,H2能将NO3—还原为N2,25℃时,反应进行10min,溶液的pH由7变为12。
①N2的结构式为 。
②上述反应离子方程式为 ,其平均反应速率v(NO3—)为 。
|
。
④在NaNO2 溶液中,质子守恒表达式为
___________________________________________。
(2)电化学降解NO3—的原理如右图所示。
| |
阴极反应式为:
。
查看习题详情和答案>>
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是
(2)Ⅱ中反应的离子方程式是
(3)A的化学式是
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是