摘要:1.水解规律:有弱才水解.无弱不水解.都弱都水解.越弱越水解.谁强显谁性.
网址:http://m.1010jiajiao.com/timu3_id_79637[举报]
判断盐溶液的酸碱性
(1)强碱弱酸正盐:________发生水解,溶液显________性.
(2)强酸弱碱正盐:________发生水解,溶液显________性.
(3)强酸强碱正盐:不发生水解.
(4)弱酸弱碱正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱.
(5)酸式盐:强酸酸式酸根离子只电离不水解,溶液呈酸性;而弱酸的酸式酸根离子既电离又水解,若电离程度大于水解程度,溶液呈酸性,若水解程度大于电离程度,溶液呈碱性.
简言之,“有弱才水解,无弱不水解,都弱都水解;谁弱谁水解,越弱越水解;谁强显谁性,都弱具体定”.
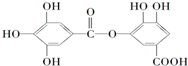 有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述,正确的是( )
有一种有机化合物,其结构简式如图所示,下列有关它的性质的叙述,正确的是( )| A、在一定条件下,1mol该物质最多能与6mol NaOH完全反应 | B、有弱酸性,1mol该有机物与溴水反应,最多能消耗4mol Br2 | C、在Ni催化下,1mol该物质可以和7mol H2发生加成反应 | D、它能发生水解反应,水解后只能生成两种产物 |
 有一种有机物的结构简式如图:下列有关它的性质的叙述,正确的是( )
有一种有机物的结构简式如图:下列有关它的性质的叙述,正确的是( )| A、它有弱酸性,能与氢氧化钠反应 | B、它不能发生水解反应 | C、它能发生水解反应,水解后生成两种物质 | D、它能发生水解反应,水解后只生成一种物质 |
已知:Na2HPO4溶液PH值约为9,NaH2PO4溶液PH值约为6,又知:在Na2HPO4溶液中滴加AgNO3溶液时,有Ag3PO4黄色沉淀生成,溶液则由反应前的弱碱性转变为反应后的弱酸性.
(1)Na2HPO4溶液呈弱碱性的原因是
(2)在Na2HPO4溶液中加入少量AgNO3溶液产生Ag3PO4沉淀的离子方程式是
查看习题详情和答案>>
(1)Na2HPO4溶液呈弱碱性的原因是
HPO42-水解程度大于电离程度
HPO42-水解程度大于电离程度
,表示这一反应的离子方程式是HPO42-+H2O=H2PO4-+OH-
HPO42-+H2O=H2PO4-+OH-
(2)在Na2HPO4溶液中加入少量AgNO3溶液产生Ag3PO4沉淀的离子方程式是
2HPO42-+3Ag+=Ag3PO4↓+H2PO4-
2HPO42-+3Ag+=Ag3PO4↓+H2PO4-
.[选修5有机化学基础]
化合物A(HOCH2CH2Cl)和B[HN(CH2CH3)2]是合成药品PLKY的重要中间体.已知:硝基苯可还原成苯胺,苯胺显弱碱性,易被氧化.PLKY的合成路线如下:
(1)甲的结构简式是
 ,丙与B反应的反应类型是
,丙与B反应的反应类型是
(2)乙与A反应的化学方程式是:
 .
.
(3)PLKY有两种水解产物丁和戊.
①戊与甲互为同分异构体,戊的结构简式 是
 .
.
②戊经聚合反应制成的髙分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是

③某有机物C的分子式为C2H4O,通过光谱分析得知分子内除C一H键、C-C键外还含有两个C一O单键,这种光谱是
 .
.
查看习题详情和答案>>
化合物A(HOCH2CH2Cl)和B[HN(CH2CH3)2]是合成药品PLKY的重要中间体.已知:硝基苯可还原成苯胺,苯胺显弱碱性,易被氧化.PLKY的合成路线如下:
(1)甲的结构简式是


取代反应
取代反应
.
(2)乙与A反应的化学方程式是:


(3)PLKY有两种水解产物丁和戊.
①戊与甲互为同分异构体,戊的结构简式 是


②戊经聚合反应制成的髙分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是


③某有机物C的分子式为C2H4O,通过光谱分析得知分子内除C一H键、C-C键外还含有两个C一O单键,这种光谱是
红外
红外
光谱,C与B在一定条件下反应可生成丁,该反应的化学方程式是
