摘要:1mol 0.8mol 0.02mol (1). (2). (3). 5注意密度变化规律 在溶液混合和溶液稀释等问题中.在注意溶液体积变化的同时.还要考虑溶液密度的变化对溶液物质的量浓度的影响.如强酸.强碱.盐等溶液的密度随浓度增大而增大,氨水.乙醇等溶液的密度随浓度增大而减小. 例5:若以和分别表示浓度为和氨水的质量分数.且知2a=b.则下列推断正确的是( ) A. B. C. D. 解析:设溶液的体积为VL.密度为.溶质的摩尔质量为M g·.质量分数为w.物质的量浓度为.根据溶液物质的量浓度的表达方式不同.但其溶质的量不变.有V L×103 mL·.即.依题意有.因2a=b.所以有.又由于氨水的密度比纯水小.且浓度越大.密度越小.即.代入上式.故答案为C项. 6注意实验情景 在计算溶液配制或溶液稀释等问题中溶液物质的量浓度时.一要注意不能把水的体积当作溶液的体积,二是在配制溶液时.要注意容量瓶规格与实际配制溶液体积的关系. 例6:实验室需用480mL 的硫酸铜溶液.现选取500mL容量瓶进行配制.以下操作正确的是( ) A. 称取7.68g硫酸铜.加入500mL水 B. 称取12.0g胆矾配成500mL溶液 C. 称取8.0g硫酸铜.加入500mL水 D. 称取12.5g胆矾配成500mL溶液 解析:一些同学通过计算.得溶质的质量.选A项,也有一些同学选C项.这里包含两个错误:一是用500mL容量瓶进行配制时.溶质的质量应满足500mL容量瓶的需求,二是错把溶剂的体积当作溶液的体积.正确情况应该是“称取8.0g硫酸铜.加水至500mL. 故答案为D项. 7注意物质与其组成微粒的关系 物质与其组成微粒的物质的量.物质的量浓度之间的关系可以通过电离方程式进行分析.组成微粒的某量=对应物质的某量×物质组成中该微粒的数目.此类问题在近几年高考中出现频率较高.需引起注意. 例7:今有300mL 溶液.溶液和 溶液.这三种溶液中的浓度之比为( ) A. 1:1:1 B. 3:2:1 C. 3:2:3 D. 1:1:3 解析:本题易错选A项或C项.错选A项是对物质与其组成微粒的关系把握不准造成的,错选C项是因为审题不仔细.有些同学看到浓度.体积就想到求物质的量.将题设数据分别相乘.再比较得到C项.而未细看题目要求.本题是要计算的浓度之比.审题仔细后.很容易得到答案为D项. 专题训练
网址:http://m.1010jiajiao.com/timu3_id_79327[举报]
450℃时,向一定体积的透明容器通入或加入下列各组物质,达到平衡时,颜色最深的是________,碘蒸气的体积分数不相同的是________(填序号).
[ ]
A.0.1mol I2 0.1mol H2 0.4mol HI
B.0.01mol H2 0.8mol HI
C.0.05mol I2 0.05mol H2 0.4mol HI
D.0.8mol HI
查看习题详情和答案>>(I)下列反应在210℃达到平衡:
PCl5(气) PCl3(气)+Cl2(气);△H>0 K=1 ①
PCl3(气)+Cl2(气);△H>0 K=1 ①
CO(气)+Cl2(气) COCl2(气);△H<0 K=5×104 ②
COCl2(气);△H<0 K=5×104 ②
COCl2(气) CO(气)+Cl2(气);△H>0③
CO(气)+Cl2(气);△H>0③
(1)反应②和反应③的K值表达式
(2)降低Cl2浓度,反应③的K值
(3)要使反应①和反应②的K值相等,应采取的措施是
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c)反应①降低温度,反应②维持210℃
(Ⅱ)(10分)现将水蒸汽和CO气体分别通入到体积为1L的恒容密闭容器中进行反应.H2O(g)+CO(g) CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:
(1)由以上数据,实验1中以v(CO2)表示的反应速率为
(2)比较该反应实验1和实验2中CO的转化率:a1
(3)若实验3要达到与实验2等效的平衡状态,且t<3min,则a、b应满足的关系是
(4)900℃时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可采取的措施有(填字母)
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D.缩小容器体积.
查看习题详情和答案>>
PCl5(气)
 PCl3(气)+Cl2(气);△H>0 K=1 ①
PCl3(气)+Cl2(气);△H>0 K=1 ①CO(气)+Cl2(气)
 COCl2(气);△H<0 K=5×104 ②
COCl2(气);△H<0 K=5×104 ②COCl2(气)
 CO(气)+Cl2(气);△H>0③
CO(气)+Cl2(气);△H>0③(1)反应②和反应③的K值表达式
不同
不同
;(填“相同”或“不同”)(2)降低Cl2浓度,反应③的K值
不变
不变
;(填“增大”、“减少”或“不变”)(3)要使反应①和反应②的K值相等,应采取的措施是
a
a
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c)反应①降低温度,反应②维持210℃
(Ⅱ)(10分)现将水蒸汽和CO气体分别通入到体积为1L的恒容密闭容器中进行反应.H2O(g)+CO(g)
 CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H.得到以下三组数据,据此回答下列问题:| 实验组 | 温度 | 起始量 | 平衡量 | 达到平衡所需时间 | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650℃ | 1mol | 2mol | 0.8mol | 0.8mol | 5min |
| 2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.2mol | 3min |
| 3 | 900℃ | a mol | b mol | c mol | d mol | t |
0.16
0.16
mol?L-1?min-1;(2)比较该反应实验1和实验2中CO的转化率:a1
>
>
a2;该反应的反应热△H<
<
0;(两空填“>”、“=”或“<”)(3)若实验3要达到与实验2等效的平衡状态,且t<3min,则a、b应满足的关系是
b=2a>l
b=2a>l
,实验3条件时反应的平衡常数为0.167
0.167
;(4)900℃时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可采取的措施有(填字母)
B、C
B、C
.A.使用高效催化剂 B.增大H2浓度 C.升高温度 D.缩小容器体积.
(16分)一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反:3A(g)+B(g)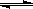 xC(g)
xC(g)
请填写下列空白:
(1)若容器体积固定为 2L,反应2min时测得剩余0.6mol B,C的浓度为0.4mol/L。
①2min内,A的平均反应速率为 ;x= ;
②若反应经4min达到平衡,平衡时C的浓度 0.8mol/L(填“大于”、“等于”或“小于”)
③平衡混合物中,C的体积分数为22%,则B的转化率是 ;
④改变起始物加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的质量的量n(A)、n(B)、n(C)之间应该满足的关系式为 。(请用2个等式表示)
(2)若维持容器压强不变
①达到平衡时C的体积分数 22%,(填“大小”、“等于”或“小于”)
②改变起始物质加入质量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入 molA气体和 molB气体。
查看习题详情和答案>>