摘要:1.如表所示是元素周期表的一部分.A元素的原子中最外层电子数是其电子层数的两倍.且A处于元素周期表中主族的正中间. (1)在表中填写其他元素的符号.其中原子半径最大的是 . (2)A与表中同周期元素形成的化合物的化学式为 .A与其他三种元素形成的化合物中有两种能与水发生水解反应.请写出其中之一与水作用的化学方程式 . (3)表中某种元素的最高价氧化物对应的水化物与气态氢化物反应.生成物中存在的化学键有 . (4)将表中四种元素分为两组.下列可以把两组内元素的金属性或非金属性都能加以比较的是( ) A.最高价氧化物对应水化物的酸碱性 B.单质与同浓度的酸反应放出氢气的快慢 C.相互之间发生的置换反应 D.单质与热水反应的剧烈程度 解析:将元素周期表知识融合在大题中进行考查也常在高考中出现.它基于考纲中要求掌握元素周期律的实质.了解元素周期表的结构及其应用这一考点.本题实际上是一道推断题.也从侧面考查了元素位.构.性三者之间的关系.首先根据A元素原子的核外电子排布特点确定A是C.则其他三种元素是Mg.Al和N.C和这三种元素形成的常见化合物有C3N4.Al4C3及MgC2.其中后两种物质在水中很容易发生水解反应.表中元素的最高价氧化物对应的水化物与气态氢化物能发生反应的只有N.产物是NH4NO3.存在的化学键有离子键和共价键.在备考复习过程中同学们应注意以下“三角 递变关系:(1)若A.B.C三种元素位于元素周期表中如图所示位置.则有关的各种性质均可排出顺序.如:①原子半径:C>A>B,②金属性:C>A>B,③非金属性:B>A>C.(2)元素周期表中的相似规律:①同主族元素性质相似(因为最外层电子数均相同),②元素周期表中位于对角线位置的元素性质相似.如Li和Mg.Be与Al.B和Si等,③相邻元素性质差别不大. 答案:(1) 镁 (2)C3N4 Al4C3+12H2O===4Al(OH)3↓+3CH4↑离子键.共价键 (4)A
网址:http://m.1010jiajiao.com/timu3_id_79103[举报]
如图所示是元素周期表的一部分。A、B、C、D均为短周期元素,若C原子最外层电子数是其内层电子数的3/5,则下列说法不正确的是( )
A.气态氢化物的稳定性:A>D
B.B元素的两种同素异形体常温下都是气体
C.最高价氧化物对应水化物的酸性:D>C
D.阴离子半径从大到小的排列顺序为:C>D>B
查看习题详情和答案>>
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的7/10。则下列说法中不正确的是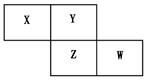
| A.原子半径由大到小排列顺序Z>Y>X |
| B.Y元素的两种同素异形体在常温下都是气体 |
| C.最高价氧化物对应水化物的酸性W>Z |
| D.阴离子半径由大到小排列顺序Z>W>Y |
如图所示是元素周期表的一部分,X、Y、Z、W均为短周期元素,若W原子最外层电子数是其内层电子数的7/10。则下列说法中不正确的是
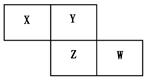

| A.原子半径由大到小排列顺序Z>Y>X |
| B.Y元素的两种同素异形体在常温下都是气体 |
| C.最高价氧化物对应水化物的酸性W>Z |
| D.阴离子半径由大到小排列顺序Z>W>Y |
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
|
|
W |
Z |
|
X |
Y |
|
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y<W
D.W、Z的氧化物都能与碱反应生成盐和水
查看习题详情和答案>>
如图所示为元素周期表的一部分,X、Y、W、Z均为短周期元素,其中只有X为金属元素。下列说法错误的是
|
|
W |
Z |
|
X |
Y |
|
A.原子半径:Z<W<Y<X
B.元素Y的氧化物能与NaOH溶液反应
C.最简单气态氢化物的热稳定性:Y>X
D.W、Z的氧化物都能与碱反应生成盐和水
查看习题详情和答案>>