网址:http://m.1010jiajiao.com/timu3_id_78427[举报]
 NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。
NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 _________________________________。(2)老师给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明醋酸是弱酸。药品为冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
①设计的理论依据是_______________________________________;
②实验的简要步骤是_______________________________________;
③需记录的现象和数据是__________________________________;
④推断与分析:由于___________________________,说明________________,所以醋酸是弱酸。
 NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 ______________________________________________________。
NH4++OH-的电离平衡(要求写出简单操作、现象及实验能说明的问题)。 ______________________________________________________。 (2)老师给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明醋酸是弱酸。药品为冰醋酸、蒸馏水和pH试纸。此同学思考后认为:
①设计的理论依据是_______________________________;
②实验的简要步骤是_______________________________;
③需记录的现象和数据是___________________________;
④推断与分析:由于_________________,说明________________,所以醋酸是弱酸。
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验
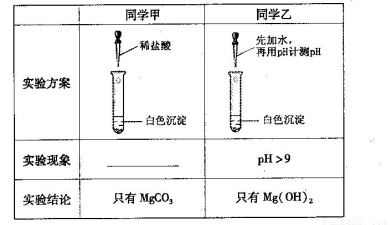
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。
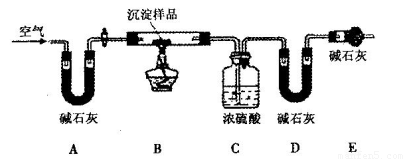
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
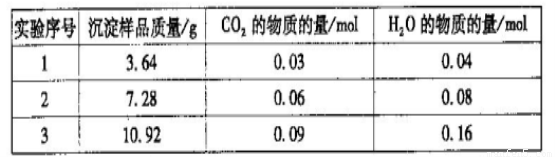
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
 ??
??
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O?????? b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O??? d.Mg5(OH)4(CO3)3·2H2O
查看习题详情和答案>>