摘要:能区别NaBr,KI,NaCl,Na2Cl,Na2CO3和Na2SO4五种固体的试剂是 A.AgNO3溶液 B.溴水 C.BaCl2溶液 D.浓硫酸
网址:http://m.1010jiajiao.com/timu3_id_78164[举报]
元素在元素周期表中的位置,反映了元素的原子结构和元素的性质。下图是元素周期表的一部分:
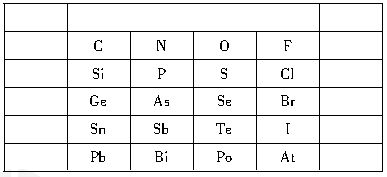
(1)一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列对同主族元素所组成的物质的性质的推理中不正确的是______。
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2也能置换出KI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
(2)表中P元素原子的电子排布式为_________;As的原子结构示意图是__________________。
(3)根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱:________>_______;As、Se气态氢化物的稳定性:________>________。
(4)比较N和O的第一电离能的大小:________>______,原因是______________________________。 查看习题详情和答案>>

(1)一般地,同一主族的元素最外层电子数相同,其单质及其对应的化合物具有相似的性质。下列对同主族元素所组成的物质的性质的推理中不正确的是______。
A.Na与Cl2反应能形成离子键,故K与Cl2反应也能形成离子键
B.Cl2能置换出NaBr溶液中的溴,故Br2也能置换出KI溶液中的碘
C.Li在氧气中燃烧生成Li2O,故Na在氧气中燃烧生成Na2O
D.C在自然界有稳定的单质存在,故Si在自然界也有稳定的单质存在
(2)表中P元素原子的电子排布式为_________;As的原子结构示意图是__________________。
(3)根据元素周期律,请你预测:
H3AsO4、H3PO4的酸性强弱:________>_______;As、Se气态氢化物的稳定性:________>________。
(4)比较N和O的第一电离能的大小:________>______,原因是______________________________。 查看习题详情和答案>>
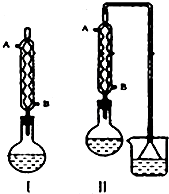 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:n-C4H9OH+NaBr+H2SO4→n-C4H9Br+NaHSO4+H2O
副反应:n-C4H9OH
| 浓H2SO4 |
| △ |
2n-C4H9OH
| ||
| △ |
3H2SO4(浓)+2NaBr(固)═2NaHSO4+Br2↑+SO2↑+2H2O
已知反应物及其用量:固体NaBr0.24mol,n-C4H9OH0.20mol,浓H2SO429mL,H2O20mL.
制备过程经历如下五个步骤,试回答下列问题:
1.投料:在圆底烧瓶中加入20mL水,再慢慢加入29mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20mol正丁醇(约18mL)和0.24mol溴化钠,充分振荡后加入几粒沸石.
(1)冷却至室温后再加正丁醇和溴化钠的目的是
A.减少HBr的挥发B.防止正丁醇的挥发
C.防止溴化钠被氧化D.防止温度过高导致炭化结焦
(2)本反应中硫酸与溴化作作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷.硫酸的用量和浓度过大都对本制备不利的主要原因是
2.加热回流:反应装置选择Ⅱ而不选择Ⅰ的原因是
3.分离粗产物:反应结束待反应液冷却后,用直形冷凝管换下球形冷凝管,将其变为蒸馏装置进行蒸馏,得到的粗产物中除主产品外,还含下列选项中的
①C4H9OH ②SO2 ③(C4H9)2O ④Br2⑤NaHSO4 ⑥H2O ⑦H2SO4
4.洗涤粗产物:将馏出液移至分液漏斗中,加入等体积的水洗涤后,分液得有机层.如果不能判断哪层是有机层,可以用
5.收集产物:将干燥好的产物移至小蒸馏瓶中,加热蒸馏,收集99-103℃的馏分.要证明最终产物是n-C4H9Br,方法是
(8分)用符号“>”“<”或“=”连接下列各项关系。
(1)第一电离能N______O; (2)电负性:N______C;
(3)键的极性:H-C______H-Si ; (4)键角:H2S______NH3
(5)分子中σ键数目:C6H6______C3H8; (6)分子中π键数目:C2H4______C2H2
(7)晶格能:MgO______KI (8)原子化热:Na ______K
查看习题详情和答案>>