网址:http://m.1010jiajiao.com/timu3_id_77504[举报]
有人设计了如右图所示实验装置,目的是做钠与水反应的实验并验证:
①钠的物理性质 ②钠与水反应的产物是什么
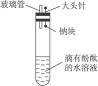
(1)当进行适当操作时还需要的仪器有_________________________________。
(2)如何进行操作?____________________________________。
(3)实验现象是________________________________________。
查看习题详情和答案>>有人设计了如右图的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。
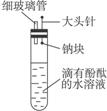
(1)为了完成他的实验,还需要的仪器有___________________________________________。
(2)假如已按如图所示装配好了仪器,接下来的操作是______________________________。
(3)实验现象是________________________________________________________________。
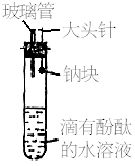
查看习题详情和答案>>有人设计了如右图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物是什么。

(1)当进行适当操作时还需要的仪器有_________________________________;
(2)如何进行操作?_____________________________________________________________;
(3)实验现象是________________________________________________________________。
查看习题详情和答案>>有人设计了如右图所示的实验装置,目的是做钠与水反应的实验并验证:①钠的物理性质;②钠与水反应的产物。
请回答下列问题:
(1)当进行适当操作时,还需要的仪器有_______。
(2)操作方法是____________________________。
(3)实验现象是____________________________。
(4)本实验能证明钠的物理性质有__________,能证明钠与水反应生成的产物除H2外,还有_____,实验现象是__________________。
实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下:
请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)
(2)写出步骤I中发生的化学反应方程式
_______________________________________________________。
若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。
(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①此处通入氨气的作用是_________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
②已知四种相关物质不同温度下的溶解度曲线如图所示。结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。
具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_____。
查看习题详情和答案>>