摘要:1383.已知泡沫灭火剂的原料主要是Al2(SO4)3和NaHCO3溶液.干粉灭火剂主要含NaHCO3.下列材料能用于扑灭金属钠着火的是( ) A.普通黄砂子 B.干冰灭火剂 C.干粉灭火剂 D.泡沫灭火剂
网址:http://m.1010jiajiao.com/timu3_id_74074[举报]
由固体碱熔氧化法可制备重铬酸钾,已知精选后的铬铁矿主要成分是亚铬酸铁[Fe(CrO2)2或
FeO·Cr2O3],还含有硅、铝的氧化物等杂质。
FeO·Cr2O3],还含有硅、铝的氧化物等杂质。
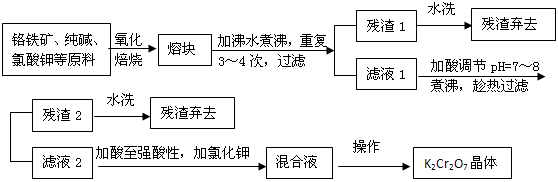
(1)若氧化焙烧在实验室进行,所用的主要仪器是______(填序号,下同);蒸发浓缩时所用的主要仪器是_______。
A.蒸发皿 B.普通坩埚 C.铁坩埚
(2)氧化焙烧时,发生重要反应的化学方程式有:

以及:__________________。
(3)用水浸取熔块时,NaFeO2强烈水解,生成氢氧化铁沉淀而除去,试写出离子方程式: __________________________________。
(4)残渣2的主要成分有(填化学式)___________、_____________。
(5)已知K2Cr2O7和NaCl两种物质的溶解度随温度变化变化如下
A.蒸发皿 B.普通坩埚 C.铁坩埚
(2)氧化焙烧时,发生重要反应的化学方程式有:

以及:__________________。
(3)用水浸取熔块时,NaFeO2强烈水解,生成氢氧化铁沉淀而除去,试写出离子方程式: __________________________________。
(4)残渣2的主要成分有(填化学式)___________、_____________。
(5)已知K2Cr2O7和NaCl两种物质的溶解度随温度变化变化如下
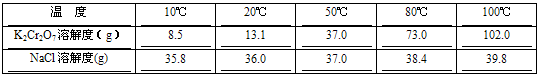
则最后一步由混合液转变成K2Cr2O7晶体的操作是_______、_______、过滤、洗涤、烘干。
查看习题详情和答案>>
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O
2CH3COOH.
③已知乳酸F的结构简式为 .
.
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示

回答下列问题:
(1)E的结构简式为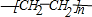
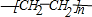
(2)F分子中含
(3)验证D和F兼有的官能团常采用的试剂是
(4)写出下列反应的反应类型:①
(5)写出下列反应的化学方程式:
① +2Na→
+2Na→ +H2↑
+H2↑ +2Na→
+2Na→ +H2↑.
+H2↑.
查看习题详情和答案>>
| ||
| △ |
③已知乳酸F的结构简式为
 .
.现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示

回答下列问题:
(1)E的结构简式为
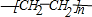
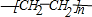
(2)F分子中含
羧基
羧基
和醇羟基
醇羟基
两种官能团(写名称)(3)验证D和F兼有的官能团常采用的试剂是
紫色的石蕊试液(或碳酸钠溶液)
紫色的石蕊试液(或碳酸钠溶液)
,产生的现象为溶液变红或有气泡产生
溶液变红或有气泡产生
(4)写出下列反应的反应类型:①
加成反应
加成反应
,④酯化反应(或取代反应)
酯化反应(或取代反应)
.(5)写出下列反应的化学方程式:
①
CH2=CH2+H2O→CH3CH2OH
CH2=CH2+H2O→CH3CH2OH
;②2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
| △ |
2CH3CH2OH+O2
2CH3CHO+2H2O
;③F与金属钠反应的化学方程式为| Cu |
| △ |
 +2Na→
+2Na→ +H2↑
+H2↑ +2Na→
+2Na→ +H2↑
+H2↑(2013?重庆模拟)I.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入图1装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极.

接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图2(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式
(2)电极f上发生的电极反应为
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是
II.工业上利用BaSO4制备BaCl2的工艺流程如下:

某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S.Na2S水溶液显碱性的原因是
(2)已知有关反应的热化学方程式如下:
BaSO4(s)+4C(s)
4CO(g)+BaS(s)△H1=+571.2kJ/mol
C(s)+CO2(g)
2CO(g)△H2=+172.5kJ/mol
则反应BaSO4(s)+2C(s)
2CO2(g)+BaS(s)△H3=
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是
查看习题详情和答案>>

接通电源,经过一段时间后,测得乙中c电极质量增加.常温下各烧杯中溶液pH与电解时间t的关系如图2(忽略因气体溶解带来的影响).据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式
2CuSO4+2H2O
2Cu+O2↑+H2SO4
| ||
2CuSO4+2H2O
2Cu+O2↑+H2SO4
;
| ||
(2)电极f上发生的电极反应为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是
向丙烧杯中加入水2.25g
向丙烧杯中加入水2.25g
.II.工业上利用BaSO4制备BaCl2的工艺流程如下:

某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验.
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S.Na2S水溶液显碱性的原因是
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
S2-+H2O?HS-+OH-、HS-+H2O?H2S+OH-
(用离子方程式表示).(2)已知有关反应的热化学方程式如下:
BaSO4(s)+4C(s)
| 高温 |
C(s)+CO2(g)
| 高温 |
则反应BaSO4(s)+2C(s)
| 高温 |
+226.2
+226.2
kJ/mol(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是
使BaSO4得到充分的还原(或提高BaS的产量)
使BaSO4得到充分的还原(或提高BaS的产量)
,硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温
硫酸钡和碳反应为吸热反应,炭和氧气反应放热维持反应所需高温
.已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2
2CH3COOH.③已知乳酸E的结构简式为 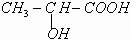 .现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
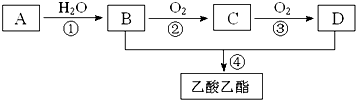
回答下列问题:
(1)A的电子式 A结构简式
(2)E的分子中含 和 两种官能团(写名称)
(3)验证D和E兼有的官能团常采用的试剂是 ,产生的现象为
(4)写出下列反应的化学方程式并注明反应类型:
A→B ;
B→C ;
两分子E在一定条件下反应生成六元环状酯的反应 .
查看习题详情和答案>>
| ||
| △ |
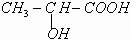 .现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
回答下列问题:
(1)A的电子式
(2)E的分子中含
(3)验证D和E兼有的官能团常采用的试剂是
(4)写出下列反应的化学方程式并注明反应类型:
A→B
B→C
两分子E在一定条件下反应生成六元环状酯的反应
(1)矿泉水中往往含多种有益于人体健康的成分.如图是某品牌矿泉水中标签上的部分内容,则这瓶矿泉水中含Ca2+的物质的量≥
(2)现代生活离不开铝,工业上以铝土矿为原料生产铝.现将一定量某铝土矿样品(主要成分Al2O3)溶于过量稀盐酸并制成500mL溶液.取100mL该溶液,测得其中含有H+、Cl-、Mg2+、Al3+、Fe3+五种离子(不考虑其它离子).已知部分离子的物质的量浓度为:
c(H+)=0.02mol?L-1 c(Mg2+)=0.01mol?L-1
c(Fe3+)=0.02mol?L-1 c(Cl-)=0.52mol?L-1
①溶液中Al3+物质的量浓度为
②则该铝土矿样品中Al2O3的质量为
查看习题详情和答案>>
5×10-5
5×10-5
mol.| 净含量:500mL | |
| 饮用水矿物质成分(mg.L-1) | |
| 钙Ca | ≥4.0 |
| 镁Mg | ≥1.0 |
| 钠Na | ≥3.0 |
c(H+)=0.02mol?L-1 c(Mg2+)=0.01mol?L-1
c(Fe3+)=0.02mol?L-1 c(Cl-)=0.52mol?L-1
①溶液中Al3+物质的量浓度为
0.14
0.14
mol?L-1②则该铝土矿样品中Al2O3的质量为
3.57
3.57
g(精确至0.01g).