摘要:1411.已知NH+OH- NH3↑+H2O.将金属钾投入到下列溶液中.有气体放出.且溶液质量减小的是( ) A.H2SO4 B.(NH4)2SO4 C.CuCl2 D.NaCl
网址:http://m.1010jiajiao.com/timu3_id_74063[举报]
在化工生产中,要用到一种无色、易溶于水的晶体——铝铵矾,该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵,向该盐的浓溶液中逐滴加入浓NaOH溶液,将发生一系列变化。已知NH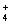 与AlO
与AlO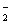 在水溶液中不能大量共存,会发生如下反应:NH
在水溶液中不能大量共存,会发生如下反应:NH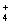 +AlO
+AlO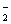 +H2O
+H2O Al(OH)3↓+NH3↑。试回答:
Al(OH)3↓+NH3↑。试回答:
(1)写出硫酸铝铵在水溶液中的电离方程式: 。?
若将硫酸铝铵溶液加入水稀释,物质的量浓度上升的离子是 (填离子符号)。?
(2)在逐滴加入NaOH溶液的过程中,产生的现象有:
①溶液中出现白色沉淀?
②有刺激性气味的气体放出?
③白色沉淀量逐渐增多?
④白色沉淀完全消失
⑤白色沉淀逐渐减少
请排出以上各种现象由先到后出现的正确顺序 (用序号回答)。?
(3)请写出有关反应的离子方程式:
① 。?
② 。?
③ 。
查看习题详情和答案>>(1)配平下列离子反应方程式:
________Fe(OH)3+________ClO-+________OH-![]() ________FeO4n-+________Cl-+________H2O
________FeO4n-+________Cl-+________H2O
(2)已知有3.21 g Fe(OH)3参加反应,共转移了5.4×1022个电子,则n=________,FeO4n-中铁元素的化合价为________.
(3)根据(1)、(2)推测,FeO4n-能和下列________(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
已知H++OH-═H2O生成1mol H2O放出57.3kJ热量,下列过程中放出热量为57.3kJ的是( )
| A、1mol H2SO4与足量的NaOH溶液反应 | B、稀盐酸与氨水反应生成1mol H2O | C、稀盐酸与Ba(OH)2溶液反应生成1mol H2O | D、稀NaOH与98%浓硫酸反应生成1mol H2O |
已知反应:X+Y=M+N为放热反应,对该反应的下列说法正确的是( )
| A、该反应为放热反应,因此不必加热即可反应 | B、X能量一定高于M | C、X和Y的总能量一定高于M和N的总能量 | D、Y能量一定高于N |