网址:http://m.1010jiajiao.com/timu3_id_73492[举报]
向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应;
![]()
已知:平均反应速率![]() ;反应2min时,A的浓度减少了
;反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有amolD生成。
mol,有amolD生成。
回答下列问题:
(1)反应2min内,![]() =,
=,![]() ;
;
(2)化学方程式中,![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(3)反应平衡时,D为2amol,则B的转化率为;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5amol,则该反应的![]()
0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”),理由是;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是;
查看习题详情和答案>>向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x= 、y= 、p= 、q= ;
(2)反应2min内,vA = ;
(3)反应平衡时,D为 2amol,则B的转化率为 ;
(4)已知该反应在不同温度下的平衡常数如下:
| 温度℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:
xA(g)+yB(g) pC(g)+qD(g)
已知:平均反应速率vC=vA/2;反应2min 时,A的物质的量减少了1/3,B的物质的量减
少了a/2 mol,有a mol D生成。请计算回答:(写出计算过程)
(1)反应2min内,v(A) =__________________
(2)化学方程式中,x= 、y= 、p= 、q= 。
(3)平衡时,D为 2a mol,此时B的物质的量浓度为?
查看习题详情和答案>>
向2L密闭容器中通入amol 气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g)pC(g)+qD(g)。
已知:平均反应速率vC=1/2vA;反应2min 时,A的浓度减少了1/3,B的物质的量减少了a/2mol,有a mol D生成。
回答下列问题:
(1)化学方程式中,x= 、y= 、p= 、q= ;
(2)反应2min内,vA = ;
(3)反应平衡时,D为 2amol,则B的转化率为 ;
(4)已知该反应在不同温度下的平衡常数如下:
| 温度℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
该反应的平衡常数表达式K=_____________,ΔH________0(填“>”、“<”或“=”);
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率 (填“增大”、“减小”或“不变”) ;
②平衡时反应物的转化率 (填“增大”、“减小”或“不变”),理由是
。
查看习题详情和答案>>
(5分)
向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应;
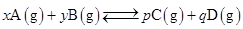
已知:平均反应速率![]() ;反应2min时,A的浓度减少了
;反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有amolD生成。
mol,有amolD生成。
回答下列问题:
(1)反应2min内,![]() =,
=,![]() ;
;
(2)化学方程式中,![]() 、
、![]() 、
、![]() 、
、![]() ;
;
(3)反应平衡时,D为2amol,则B的转化率为;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5amol,则该反应的![]()
0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”),理由是;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是;
查看习题详情和答案>>