摘要:17.平衡移动原理可解释许多化学现象和自然现象.下列两组反应能否实现?如能实现请简述实验方法: (1)4H2 + Fe3O4 3Fe + 4H2O.3Fe + 4H2O 4H2 + Fe3O4, (2)SO2 + Br2 + 2H2O = 2HBr + H2SO4.2HBr + H2SO4=SO2 + Br2 + 2H2O, .
网址:http://m.1010jiajiao.com/timu3_id_73391[举报]
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
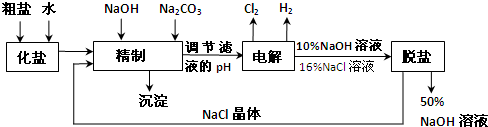
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 .
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 .
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序).
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: .
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 (填操作名称)而制得50%的NaOH溶液.
查看习题详情和答案>>

依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为
(3)精制过程要除去SO42-,可选择下列溶液中的
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:
(5)脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、
Al(OH)3的电离方程式可表示为:H++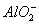 +H2O
+H2O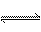 Al(OH)3
Al(OH)3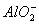 Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
Al3++3OH-。试根据平衡移动原理,解释下列有关的问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是________________________,有关的离子方程式为________________________。
查看习题详情和答案>>下列事实不能用平衡移动原理加以解释的是( )
A.升高温度促进SO2转化为SO3
B.在反应2SO2+O2![]() 2SO3中,增加O2可提高SO2的转化率
2SO3中,增加O2可提高SO2的转化率
C.可用浓NH3·H2O和烧碱固体快速制NH3
D.加压有利于SO2和O2反应生成SO3
查看习题详情和答案>>氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
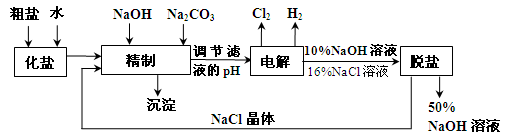
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去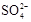 ,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的 (填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去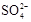 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、(填操作名称)而制得50%的NaOH溶液。
查看习题详情和答案>>