网址:http://m.1010jiajiao.com/timu3_id_73036[举报]
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。

(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
查看习题详情和答案>>
铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。
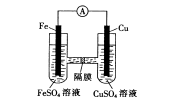
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后, ,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式 。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是 。 查看习题详情和答案>>
表一废水中各物质的含量
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是 .
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③ ,目的是使Ag+全部还原为金属Ag;
④ ,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4?7H2O晶体.
⑤将第 步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后, ,滤出FeSO4?7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式 .
(4)在步骤⑤中,加入少量硫酸调节pH的目的是 . 查看习题详情和答案>>