摘要:过氧化氢与用硫酸酸化的Mn4溶液反应.生成硫酸钾.硫酸锰.水.氧气.如果过氧化氢中的氧原子是用带放射性的示踪原子(18).则反应完毕后.18将会出现在( ) A.24中 B.Mn4中 .H2中 D.2中
网址:http://m.1010jiajiao.com/timu3_id_72357[举报]
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质.
Ⅰ.测定过氧化氢的含量
(1)取10.00mL密度为ρg/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式: .
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 .
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:
①将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为: .
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是 ,写出产生气体这一现象的反应的化学方程式 .
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是 .
查看习题详情和答案>>
Ⅰ.测定过氧化氢的含量
(1)取10.00mL密度为ρg/mL的过氧化氢溶液稀释至250mL,移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,写出滴定过程中发生反应的离子方程式:
(2)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为
Ⅱ.探究过氧化氢的性质
(1)H2O2与铜的有关探究实验:
①将铜丝置于用硫酸酸化的H2O2溶液中,铜被迅速氧化,溶液变蓝;同时产生大量气体,经检测该气体能使余烬木条复燃,反应的离子方程式为:
②将铜丝置于H2O2溶液中,没有气泡产生,加热溶液时,观察到铜丝表面产生大量气体,且气体能使余烬木条复燃,在该变化中铜丝所起的作用是
(2)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现,这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出,ClO-与H2O2反应的离子方程式是
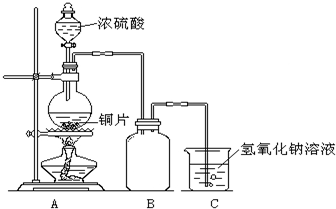 某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:
某化学课外兴趣小组为探究铜与浓硫酸的反应,用右图所示的装置进行实验:请回答下列问题:
(1)B是用来收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整.
(2)实验中他们取6.4g铜片和12mL18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余.
①写出铜与浓硫酸反应的化学方程式:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
,
| ||
实验中若有m g铜参加了反应,则有
| m |
| 64 |
| m |
| 64 |
还原
还原
(填“氧化”或“还原”),转移电子的物质的量为| m |
| 32 |
| m |
| 32 |
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是
D
D
(填写字母编号).A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
稀硫酸不与铜反应
稀硫酸不与铜反应
(3)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫.
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量.
方案三:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况).
实际上,以上方案一、二均不可取,请你说出原因?
方案一
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
产生的气体中含有水蒸气,干燥管中的质量差不仅仅是SO2的质量(或烧瓶中的二氧化硫不能完全排出)
;方案二
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
沉淀的质量一部分是高锰酸钾溶液中起酸化作用的硫酸与氯化钡反应而产生的
.方案三:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12mL)
| V |
| 22.4×0.012 |
| V |
| 22.4×0.012 |
(2013?黄山一模)铁及其化合物在生产和生活中有着广泛的应用.
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
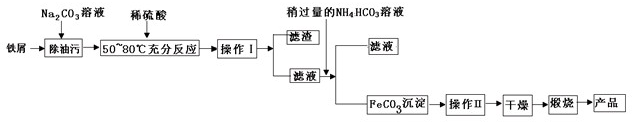
回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是
②写出在空气中煅烧FeCO3的化学方程式
③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4?7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
②计算上述样品中FeSO4?7H2O的质量分数为
③滴定达到终点时锥形瓶中溶液颜色变化为
④下列操作会导致样品中FeSO4?7H2O的质量分数的测定结果偏高的有
a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
查看习题详情和答案>>
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:

回答下列问题:
①操作Ⅰ、Ⅱ的名称分别是
过滤
过滤
、洗涤
洗涤
.②写出在空气中煅烧FeCO3的化学方程式
4FeCO3+O2=2Fe2O3+4CO2
4FeCO3+O2=2Fe2O3+4CO2
;③.煅烧如果不充分,产品中将有Fe2+ 存在,试设计实验检验产品中有无Fe2+.
(2)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定.
a.称取2.850g绿矾(FeSO4?7H2O)产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①写出酸性KMnO4溶液与FeSO4溶液反应的离子方程式
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O
②计算上述样品中FeSO4?7H2O的质量分数为
97.5%
97.5%
已知M(FeSO4?7H2O)=278g/mol]③滴定达到终点时锥形瓶中溶液颜色变化为
紫红色
紫红色
④下列操作会导致样品中FeSO4?7H2O的质量分数的测定结果偏高的有
b
b
.a.未干燥锥形瓶
b.盛装标准液的滴定管没有用标准液润洗
c. 滴定终点时滴定管尖嘴中产生气泡
d.量取待测液,视线注视刻度时开始平视、结束俯视.
下列离子方程式书写正确的是( )
| A、硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2?Fe3++H2O | ||||
| B、FeCl3溶液与Cu的反应:Cu+Fe3+?Cu2++Fe2+ | ||||
C、NO2与水的反应:3NO2+H20?2NO
| ||||
D、NH4HCO3溶于过量的NaOH溶液中:HCO
|