摘要:20.某溶液中大量存在五种离子:NO3-.SO42-.Fe3+.H+.X.其物质的量之比为:n(NO3-)∶n(SO42-)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1.则X可能为( ). A.Fe2+ B.Mg2+ C.Cl- D.Ba2+ [解析]选B.SO42-和Ba2+能够反应生成BaSO4沉淀.在酸性条件下NO3-能够将Fe2+氧化成Fe3+.所以溶液中一定没有Ba2+和Fe2+.假设题中所给的离子的物质的量依次为2mol.3mol.1mol.3mol和1mol.阳离子所带的正电荷数为:n=3n(Fe3+)+n(H+)=3×1mol+1×3mol=6mol.阴离子所带的负电荷数为:n=n(NO3-)+ 2n(SO42-)=1×2mol+2×3mol=8mol.所以还缺少2mol正电荷.因为n(X)=1mol.所以X带两个正电荷.为Mg2+.
网址:http://m.1010jiajiao.com/timu3_id_71718[举报]
某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、M(M代表一种离子),其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为( )
查看习题详情和答案>>
某溶液中大量存在五种离子: 、
、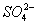 、Fe3+、H+、X,其物质的量之比为:n(
、Fe3+、H+、X,其物质的量之比为:n( )∶n(
)∶n( )∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1,则X可能为
)∶n(Fe3+)∶n(H+)∶n(X)=2∶3∶1∶3∶1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
查看习题详情和答案>>
某溶液中大量存在五种离子:NO3-、SO42-、Fe3+、H+、X,其物质的量之比为:n(NO3-)︰n(SO42-)︰n(Fe3+)︰n(H+)︰n(X)=2︰3︰1︰3︰1,则X可能为
A.Fe2+ B.Mg2+ C.Cl- D.Ba2+
查看习题详情和答案>>