网址:http://m.1010jiajiao.com/timu3_id_71517[举报]

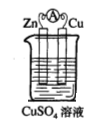
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束 时测得锌片减少了3. 94g,铜片增重了3.84g,则该原电池的工作效率是___(指参加原电池反应的锌 占反应总量的百分率)。
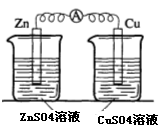
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜电极给Cu2+?___。
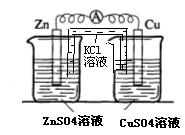
(3)实验三中盐桥中K+流向____溶液(填“ZnSO4”或“CuSO4”),如果Zn的消耗速率为1×10 -3 mol/s,则 K+的迁移速率为___mol/s。与实验一比较,实验三原电池的工作效率大大提高,原因是____ 。
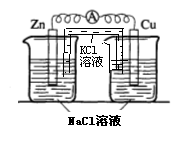
(4)实验四中电流计指针仍有偏转,写出铜电极的电极反应式:___。
(17分)某校化学兴趣小组为了探究原电池工作原理,进行如下系列实验:
实验一 实验二
实验三 实验四
结果:
(1)实验一中铜片、锌片表面均有红色物质析出,电流计指针偏转,但较短时间内电流即明显减小。实验结束时测得锌片减少了3.94g,铜片增重了3.84g,则该原电池的工作效率是(指参加原电池反应的锌占反应总量的百分率): 。
(2)实验二中刚将铜、锌片插入溶液中时电流计指针有偏转,但立即就归零了。为什么锌的电子不能持续通过导线流向铜极给Cu2+? 。
(3)实验三中盐桥中K+流向 溶液(填ZnSO4或CuSO4),如果Zn的消耗速率为1×10-3mol/s,则K+的迁移速率为 mol/s。
(4)实验四中电流计指针有偏转,写出铜极的电极反应式: ![]()
 某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
(1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:
|
紫色,对照比色卡发现其pH约为13。
①如图,右端回形针为 极(填“阴”或“阳”);
阴极试纸上出现大片蓝紫色的原因是(用反应式结合文字表示):
。
②推测阳极回形针处出现的红棕色物质可能是 (写化学式),为证明该种物质的存在,请设计一个简单的实验,该实验的操作过程是:
。
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图。接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。
 请分析此极出现该现象的原因:(用必要文字及方程式表述)
请分析此极出现该现象的原因:(用必要文字及方程式表述)
。
查看习题详情和答案>>某校化学兴趣小组同学,利用下列装置探究pH试纸上的微型电解。
 (1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
(1)如图,取一条广泛pH试纸,浸润了饱和Na2SO4溶液后放置于玻璃片上,取两只回形针(铁制)夹住试纸两端,另取导线、鳄鱼夹、6v电池连接好电路。
当两根鳄鱼夹夹住回形针后,试纸上立刻出现以下现象:
|
紫色,对照比色卡发现其pH约为13。
①如图,右端回形针为 极(填“阴”或“阳”);
阴极试纸上出现大片蓝紫色的原因是(用反应式结合文字表示): 。
②推测阳极回形针处出现的红棕色物质可能是 (写化学式),为证明该种物质的存在,请设计一个简单的实验,该实验的操作过程是: 。
 (2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(2)小组同学另取两根铅笔芯作为电极,对pH试纸上的Na2SO4溶液电解,可见阳极与试纸接触处呈现 色圆点,而在阴极与试纸接触处呈现 色圆点,说明了电解硫酸钠饱和溶液的实质是: (用方程式表示)。
(3)将pH试纸用饱和NaCl浸润,采用类似(2)操作,如图。接通直流电源一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈呈浅红色。
请分析此极出现该现象的原因:(用必要文字及方程式表述)
查看习题详情和答案>> (2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
(2011?宣城二模)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快.请分析反应逐渐加快的可能原因
(2)另称取粗铁粒10g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y.为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol?L-1 KSCN溶液;0.1mol?L-1 KI溶液;0.2mol?L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3mL溶液装于试管,向试管中加入几滴KSCN溶液. | 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ 若溶液变红色,则溶液含有Fe3+; 若无现象,则不含Fe3+ |
Fe3++3SCN-=Fe(SCN)3 Fe3++3SCN-=Fe(SCN)3 |
| 第二步 | 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 另取少量溶液装于试管,向试管里滴加几滴酸性高锰酸钾溶液 |
若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+. |
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O |
(3)装置乙的作用:
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定气体Y中含NO?说明理由.
(5)同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15mol?L-1酸性KMnO4溶液滴定,消耗20mL KMnO4溶液.则气体Y中NO、NO2的体积比为