摘要:18. (1) Al2O3+6H+=2Al3++3H 2O . (2) SiO2+2OH-=SiO32-+H2O . (3) AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- . (4) KSCN . (5) NaHCO3 . HCO3-+H2OH2CO3+OH- . (6) 5.6×10-10mol·L-1 .
网址:http://m.1010jiajiao.com/timu3_id_71387[举报]
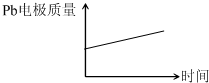
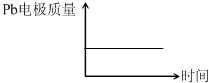
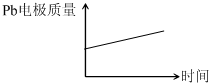
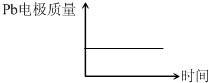
| (2013?天津)为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.反应原理如下: 电池:Pb(s)+PbO2(s)+2H2SO4(aq)═2PbSO4(s)+2H2O (l) 电解池:2Al+3H2O
电解过程中,以下判断正确的是( )
|
查看习题详情和答案>>
下表中由方程式得出的结论不合理的是( )
| 选项 | 方程式 | 结论 |
| A | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | Fe(OH)2不稳定易被氧化 |
| B | Al3++3NH3?H2O(过量)=Al(OH)3↓+3NH4+ | Al(OH)3不溶于碱 |
| C | 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O | HNO3具有强氧化性 |
| D | Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O |
Al2O3是两性氧化物 |
| A、A | B、B | C、C | D、D |