摘要:1.28g Cu完全溶于一定量的浓HNO3中.生成的气体刚好充满500mL的烧瓶.然后将该烧瓶倒置于水中.缓缓通入一定量的氧气后容器内刚好充满水.则通入的氧气为( ) A.0.16g B.0.02mol C.0.32g D.0.224g [解析]选C.铜失去的电子给了硝酸.然后硝酸被还原为氮氧化物.氮氧化物与氧气反应.氮氧化物又把电子给了氧气.相当于铜直接把电子给了氧气,由得失电子相等可以计算.n.n(Cu)×2=n(O2)×4,×2= n(O2)×4, n(O2)=0.01mol,m(O2)=0.01mol×32g/mol=0.32g.因此C选项正确.
网址:http://m.1010jiajiao.com/timu3_id_71081[举报]
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中W的最高价氧化物对应的水化物的浓溶液能与Cu反应,生成有不可燃的气体,请回答下列问题
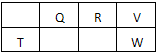
(1)元素Q、W的非金属性强弱:Q_____W(填‘>’或‘<’)。
(2)写出在加热条件下,足量R的最高价氧化物对应的水化物Y的浓溶液与Fe反应(产物中唯一的气体产物与V的单质按照物质的量之比4:1混合能完全溶于水)的离子方程式:_________________________。
(3)将mg金属Cu,完全溶解于80mL13.5mol/L的Y溶液中,收集到6.72L(标况)气体,剩余溶液中H+浓度为1mol/L。假设反应后溶液体积仍为80mL,求m=_________g。
查看习题详情和答案>>
(2)写出在加热条件下,足量R的最高价氧化物对应的水化物Y的浓溶液与Fe反应(产物中唯一的气体产物与V的单质按照物质的量之比4:1混合能完全溶于水)的离子方程式:_________________________。
(3)将mg金属Cu,完全溶解于80mL13.5mol/L的Y溶液中,收集到6.72L(标况)气体,剩余溶液中H+浓度为1mol/L。假设反应后溶液体积仍为80mL,求m=_________g。
|
25.6g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)若干,这些混合气体恰好能被500 mL 1 mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO2和NaNO3的物质的量之比为 (已知:NO+NO2+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO3+NaNO2+H2O) | |
A. |
2∶1 |
B. |
1∶1 |
C. |
4∶1 |
D. |
1∶3 |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2的混合物) 共0.8 mol,这些气体恰好能被500 mL 2 mol·L-1 NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为
(已知: 2NO2+2NaOH==NaNO2+NaNO3+H2O, NO+NO2+2NaOH==2NaNO2+H2O)
(已知: 2NO2+2NaOH==NaNO2+NaNO3+H2O, NO+NO2+2NaOH==2NaNO2+H2O)
[ ]
A.0.2 mol
B.0.4 mol
C.0.6 mol
D.0.8 mol
查看习题详情和答案>>
B.0.4 mol
C.0.6 mol
D.0.8 mol